题目内容
【题目】某矿渣所含各物质的质量分数如下表所示:
成分 | SiO2 | MgO | Fe2O3 | Al2O3 | CuO |
质量分数/% | ? | 4.0 | 32 | 10.2 | 16 |
已知常温下,几种氢氧化物开始沉淀和完全沉淀的pH如下表所示:
Cu(OH)2 | Mg(OH)2 | Fe(OH)3 | Al(OH)3 | |
开始沉淀的pH | 4.8 | 9.3 | 2.7 | 3.8 |
完全沉淀的pH | 6.4 | 10.8 | 3.7 | 4.7 |
某课题组拟以上述矿渣为原料制备金属、铝、铜、铁,其部分工艺流程如下:
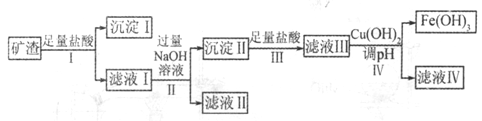
请回答下列问题:
(1)沉淀I的主要用途是_______(答一条即可),步骤IV中调节pH范围为______。
(2)由滤液II经几步反应可得到需要制备的一种金属的氧化物,滤液II中需要通入气体的化学式为__________。
(3)写出由滤液I得到滤液II的离子方程式:______________。
(4)滤液IV中含有的金属阳离子是__________,分离金属阳离子的操作是____________。
(5)工业上,冶炼铝、铁、铜、镁的方法依次是_______(填字母)。
A.电解法、热还原法、分解法、分解法
B.电解法、热还原法、热还原法、电解法
C.热还原法、分解法、电解法、电解法 .
D.热还原法、热还原法、热还原法、电解法
(6)工业上冶炼铝、铁、铜、镁时选用的相应的原料为___________(填字母)。
A.Al2O3、Fe2O3、CuO、MgO
B.Al2O3、Fe2O3、CuCl2、MgCl2
C.AlCl3、FeCl3、CuO、MgCl2
D. Al2O3、Fe2O3、CuO、MgCl2
【答案】 作光导纤维(或制石英坩埚等) 3.7≤pH<4.8 CO2 Al3++4OH-=AlO2-+2H2O Cu2+、Mg2+ 向溶液中加入过量氧化镁或碳酸镁,过滤(或向溶液中加入氢氧化钠溶液,调节溶液pH为6.4~9.3,过滤) B D
【解析】考查化学工艺流程,(1)根据矿渣的成分,MgO、Fe2O3、CuO属于碱性氧化物,Al2O3属于两性氧化物,SiO2属于酸性氧化物,I加入足量盐酸,SiO2不与盐酸反应,因此沉淀I为SiO2,是作光导纤维或石英坩埚的原料;步骤IV得到Fe(OH)3,因此加入Cu(OH)2调节pH,使Fe(OH)3沉淀,pH最小值为3.7,最大值为4.8,范围是3.7≤pH<4.8;(2)滤液I中含有金属阳离子是Mg2+、Fe3+、Al3+、Cu2+,步骤II中加入过量的氢氧化钠溶液发生的反应是:Mg2++2OH-=Mg(OH)2↓、Fe3++3OH-=Fe(OH)3↓、Cu2++2OH-=Cu(OH)2↓、Al3++4OH-=AlO2-+2H2O,滤液II溶质为NaAlO2、NaCl,制备的金属氧化物是Al2O3,因此需要通入的气体为CO2,发生的反应是AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;(3)根据上述分析,离子反应方程式为Al3++4OH-=AlO2-+2H2O;(4)根据流程,以及矿渣中含有成分,因此滤液IV中含有金属阳离子是Cu2+和Mg2+;根据氢氧化物开始沉淀和完全沉淀的pH数值,分离Mg2+和Cu2+的操作是向溶液中加入氢氧化钠溶液,调节溶液的pH为6.4~9.3,过滤,或者操作是向溶液中加入过量氧化镁或碳酸镁,过滤;(5)K-Al通常用电解法冶炼,Zn-Cu通常用热还原法冶炼,Cu以后金属通常用热分解法冶炼,故选项B正确;(6)工业上冶炼铝通常电解熔融状态下的氧化铝,冶炼铁通常用焦炭与氧化铁发生氧化还原反应得到金属铁,冶炼铜通常用焦炭与氧化铜发生氧化还原反应得到金属铜,冶炼金属镁通常用电解熔融状态的氯化镁,故选项D正确。

 阅读快车系列答案
阅读快车系列答案【题目】表是“比较过氧化氢在不同条件下的分解”实验的相关内容.请回答:
编号 | 加入材料 | 处理方法 | 实验现象 | |
1 | 2mL | H2O2溶液+2滴清水 | 室温 | 无气泡 |
2 | 2mL | H2O2溶液+2滴清水 | 90℃水浴 | 少量气泡,带火星的卫生香不复燃 |
3 | 2mL | H2O2溶液+2滴质量分数为3.5%FeCl3溶液 | 室温 | 较多气泡,带火星的卫生香复燃 |
4 | 2mL | H2O2溶液+2滴肝脏研磨液 | 室温 | 大量气泡,带火星的卫生香猛烈复燃 |
(1)该实验中,实验组是 (填试管编号),自变量是 ,因变量是酶的催化活性.
(2)比较1 号和2 号试管,你得出的结论是 .比较3号和4号试管,你得出的结论是 .
(3)某同学按照表中方法做了这个实验,结果试管3和实验4的现象刚好相反,你认为实验失败的原因最可能是: .
(4)如果图表示温度对酶的催化效率的影响,请据图回答:曲线中的AB 段表明在温度低于40℃时,酶的活性随温度升高而增强,则曲线中的BC 段表明 .


