题目内容
【题目】下列关于Si、Cl、S等非金属元素单质及其化合物的说法正确的是
A. 实验室可用浓硫酸干燥硫化氢
B. 陶瓷、水晶、水泥、玻璃都属于硅酸盐产品
C. 漂白粉变质后的残留固体有碳酸钙
D. 单质氯气及单质硫与铜反应生成的产物中,铜的化合价相同
【答案】C
【解析】
A.浓硫酸与硫化氢会发生氧化还原反应,所以浓硫酸不能干燥硫化氢,A错误;
B.水晶的主要成分为二氧化硅,而陶瓷、水泥、玻璃都属于硅酸盐产品,B错误;
C.漂白粉变质时与水、二氧化碳反应生成碳酸钙和HClO,变质后的残留固体有碳酸钙,C正确;
D.S具有弱氧化性,氯气具有强氧化性,分别与Cu反应生成Cu2S、CuCl2,Cu元素的化合价不同,D错误;
故合理选项是C。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】某矿渣所含各物质的质量分数如下表所示:
成分 | SiO2 | MgO | Fe2O3 | Al2O3 | CuO |
质量分数/% | ? | 4.0 | 32 | 10.2 | 16 |
已知常温下,几种氢氧化物开始沉淀和完全沉淀的pH如下表所示:
Cu(OH)2 | Mg(OH)2 | Fe(OH)3 | Al(OH)3 | |
开始沉淀的pH | 4.8 | 9.3 | 2.7 | 3.8 |
完全沉淀的pH | 6.4 | 10.8 | 3.7 | 4.7 |
某课题组拟以上述矿渣为原料制备金属、铝、铜、铁,其部分工艺流程如下:
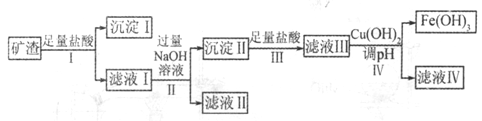
请回答下列问题:
(1)沉淀I的主要用途是_______(答一条即可),步骤IV中调节pH范围为______。
(2)由滤液II经几步反应可得到需要制备的一种金属的氧化物,滤液II中需要通入气体的化学式为__________。
(3)写出由滤液I得到滤液II的离子方程式:______________。
(4)滤液IV中含有的金属阳离子是__________,分离金属阳离子的操作是____________。
(5)工业上,冶炼铝、铁、铜、镁的方法依次是_______(填字母)。
A.电解法、热还原法、分解法、分解法
B.电解法、热还原法、热还原法、电解法
C.热还原法、分解法、电解法、电解法 .
D.热还原法、热还原法、热还原法、电解法
(6)工业上冶炼铝、铁、铜、镁时选用的相应的原料为___________(填字母)。
A.Al2O3、Fe2O3、CuO、MgO
B.Al2O3、Fe2O3、CuCl2、MgCl2
C.AlCl3、FeCl3、CuO、MgCl2
D. Al2O3、Fe2O3、CuO、MgCl2


