题目内容
【题目】将0.1 mol的镁、铝混合物溶于100 mL 2mol/L H2SO4溶液中,然后再滴加
1 mol/L NaOH溶液。请回答:
⑴ 若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。
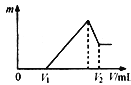
当V1=160mL时,则金属粉末中n(Mg)= mol,V2= mL。
⑵ 滴加NaOH溶液,欲使Mg2+、Al3+刚好沉淀完全,则V(NaOH)= mL。
⑶ 若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足条件的a的取值范围 。
【答案】(1)0.06 440(2)400(3)1/2 ≤a<1
【解析】
试题分析:⑴ 根据图像可知镁、铝混合物溶于100 mL 2mol/L H2SO4溶液中,硫酸有剩余,![]() 反应为
反应为![]() ,V1=160mL时硫酸的物质的量为0.08mol;所以与镁、铝混合物反应的硫酸0.12mol,设镁的物质的量为xmol,铝的物质的量为(0.1-x)mol;
,V1=160mL时硫酸的物质的量为0.08mol;所以与镁、铝混合物反应的硫酸0.12mol,设镁的物质的量为xmol,铝的物质的量为(0.1-x)mol;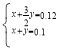 ,x=0.06;即镁的物质的量为0.06mol,铝的物质的量为0.04mol;当加入氢氧化钠
,x=0.06;即镁的物质的量为0.06mol,铝的物质的量为0.04mol;当加入氢氧化钠![]() mL时,
mL时,![]() ,镁离子消耗氢氧化钠0.12mol;
,镁离子消耗氢氧化钠0.12mol;![]() ,铝离子消耗氢氧化钠0.16mol,
,铝离子消耗氢氧化钠0.16mol,![]() =120+160+160=440mL;
=120+160+160=440mL;
⑵ 滴加NaOH溶液,欲使Mg2+、Al3+刚好沉淀完全,则溶液中的溶质只有硫酸钠,根据元素守恒,![]() ,n(NaOH)=2 n(H2SO4)= 2×0.1L ×2mol/L=0.4mol,则V(NaOH)=400mL。
,n(NaOH)=2 n(H2SO4)= 2×0.1L ×2mol/L=0.4mol,则V(NaOH)=400mL。
⑶所得沉淀中无Al(OH)3,则溶液中的溶质为![]() 、
、![]() ,根据钠元素守恒0.45=0.4+0.1×(1-a),a=0.5,即铝的最大值为0.5,所以a的取值范围是1/2 ≤a<1。
,根据钠元素守恒0.45=0.4+0.1×(1-a),a=0.5,即铝的最大值为0.5,所以a的取值范围是1/2 ≤a<1。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案【题目】由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、Cl﹣、NH4+、Mg2+、Ba2+、CO32﹣、SO42﹣ , 将该混合物溶于水后得澄清溶液,现取3份100mL 的该溶液分别进行如下实验:
实验序号 | 实验内容 | 实验结果 |
① | 加AgNO3溶液 | 有白色沉淀生成 |
② | 加足量NaOH溶液并加热 | 收集到气体1.12L(标准状况) |
③ | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加入足量稀盐酸,然后干燥、称量 | 第一次称量读数为6.27g;第二次称量读数为2.33g |
试回答下列问题:
(1)根据实验①对Cl﹣是否存在的判断是(填“一定存在”、“一定不存在”或“不能确定”),根据实验①②③判断混合物中一定不存在的离子是 .
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满)
阴离子符号 | 物质的量浓度(molL﹣1) |
(3)试确定K+是否存在并说明理由.
