题目内容
【题目】甲醇被称为21世纪的新型燃料,工业上在一定条件下可利用反应I和II来制备:
(1)已知在25°C、101kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则表示燃烧热的热化学方程式为_______________________。
(2)将1.0 molCH4和2.0 molH2O(g)通入容积为10 L密闭容器中,CH4(g)+H2O(g)![]() CO(g)+3H2(g)(I),CH4的转化率与温度、压强的关系如图所示:
CO(g)+3H2(g)(I),CH4的转化率与温度、压强的关系如图所示:
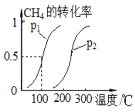
①该反应的△H______0,图中的p1 ____ p2(填“<”、“>”或“=”)
②已知100℃时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为________________,该反应的平衡常数为_______(mol·L-1)2
(3)在压强为0.1MPa条件下,amolCO与3amolH2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H<0(Ⅱ)若容器的容积不变,下列措施可增大甲醇产率的是___________(填序号).
CH3OH(g) △H<0(Ⅱ)若容器的容积不变,下列措施可增大甲醇产率的是___________(填序号).
A.升高温度 B.将CH3OH(g)从体系中分离出来
C.恒容下充入He,使体系的总压强增大 D.再充入amolCO和3amolH2.
(4)为提高燃烧效率,某燃料电池以甲醇原料,NaOH溶液为电解质,其负极电极反应式为______________
【答案】CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H= -725.76 kJ·mol-1 > < 0.030 molL-1min-1 2.25×10-2 BD CH3OH-6e-+8OH-=CO32-+6H2O
O2(g)=CO2(g)+2H2O(l) △H= -725.76 kJ·mol-1 > < 0.030 molL-1min-1 2.25×10-2 BD CH3OH-6e-+8OH-=CO32-+6H2O
【解析】
(1)结合燃烧热的概念书写甲醇燃烧的热化学方程式;
(2)①根据CH4的平衡转化率与温度、压强的关系分析判断;
②根据v=![]() 计算反应速率,根据化学平衡常数的含义计算K;
计算反应速率,根据化学平衡常数的含义计算K;
(3)平衡正向移动,就可以提高甲醇的产率;
(4)在燃料电池中,通入燃料的电极为负极,负极失去电子发生氧化反应,通入O2或空气的电极为正极,正极得到电子发生还原反应,结合电解质溶液的酸碱性书写电极反应式。
(1)甲醇的相对分子质量是32,在25°C、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则32 g甲醇完全燃烧放出热量为Q=22.68 kJ×32=725.76 kJ,所以表示甲醇燃烧热的热化学方程式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-725.76 kJ·mol-1;
O2(g)=CO2(g)+2H2O(l) △H=-725.76 kJ·mol-1;
(2)①根据图象可知:在压强不变时,温度升高,CH4的平衡转化率增大,说明升高温度,化学平衡正向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,所以该反应的正反应为吸热反应,故△H>0;该反应的正反应为气体体积增大的反应,在温度不变时,增大压强,化学平衡向气体体积减小的逆反应方向移动。根据图象可知,CH4的平衡转化率:p1>p2,说明压强:p1<p2;
②将1.0 molCH4和2.0 molH2O(g)通入容积为10 L密闭容器中发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),在100℃时达到平衡所需的时间为5 min,甲烷转化率为0.5,则反应的CH4的浓度为△c(CH4)=
CO(g)+3H2(g),在100℃时达到平衡所需的时间为5 min,甲烷转化率为0.5,则反应的CH4的浓度为△c(CH4)=![]() =0.05 mol/L,△c(H2O)= △c(CO)=△c(CH4)=0.05 mol/L,则△c(H2)=3△c(CH4)=0.15 mol/L,所以v(H2)=
=0.05 mol/L,△c(H2O)= △c(CO)=△c(CH4)=0.05 mol/L,则△c(H2)=3△c(CH4)=0.15 mol/L,所以v(H2)=![]() =0.030 mol/(L·min);平衡时:c(CH4)=0.05 mol/L,c(H2O)=(2 mol÷10 L)- 0.05 mol/L=0.15 mol/L,c(CO)= 0.05 mol/L,c(H2)= 0.15 mol/L,所以该温度下该反应的化学平衡常数K=
=0.030 mol/(L·min);平衡时:c(CH4)=0.05 mol/L,c(H2O)=(2 mol÷10 L)- 0.05 mol/L=0.15 mol/L,c(CO)= 0.05 mol/L,c(H2)= 0.15 mol/L,所以该温度下该反应的化学平衡常数K=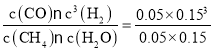 =2.25×10-2;
=2.25×10-2;
(3)根据方程式CO(g)+2H2(g)![]() CH3OH(g) △H<0可知:该反应的正反应为气体体积减小的放热反应。
CH3OH(g) △H<0可知:该反应的正反应为气体体积减小的放热反应。
A. 升高温度,化学平衡向吸热的逆反应方向移动,甲醇产率降低,A不符合题意; B. 将CH3OH(g)从体系中分离出来,即减小生成物浓度,平衡正向移动,甲醇产率增大,B符合题意;
C. 恒容下充入He,使体系的总压强增大,平衡混合物中各组分的浓度不变,化学平衡不移动,甲醇产率不变,C不符合题意;
D. 再充入amolCO和3amolH2,由于CO、H2反应的物质的量的比是1:2,所以相当于充入amolCO和2amolH2,反应达到平衡后又加入amolH2。充入amolCO和2amolH2,就是增大体积的压强,平衡正向移动,产生更多甲醇;反应达到平衡后又加入amolH2,增大H2的浓度,平衡正向移动,又产生甲醇,因此最终达到平衡时,甲醇产率增大,D符合题意;
故合理选项是BD;
(4)为提高燃烧效率,某燃料电池以甲醇原料,NaOH溶液为电解质,在燃料电池中,通入燃料的电极为负极,失去电子,发生氧化反应,由于电解质溶液为碱性,因此燃料甲醇反应产生的CO2