题目内容
【题目】已知元素X位于Y的下一周期,X、Y的原子序数均不大于20.某含氧酸盐甲的化学式 为XYO3。请回答:
(1)常温下X的单质能与水发生反应,395℃时,甲能发生分解反应生成两种盐,一种是 含Y元素的无氧酸盐,则X位于周期表_____,甲发生分解反应的化学方程式是_____。
(2) 若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体.
①则甲为_____(填化学式)该气体能使酸性高锰酸钾溶液褪色, 该反应的离子方程式为_____;
②X、Y形成简单离子半径大小关系为 > (用离子符号表示)._________
③25℃时,甲在水中的沉淀溶解平衡曲线如右图所示,若要使溶液 X2+离子沉淀完全,则 YO32-离子的最小浓度为_____mol·L-1。
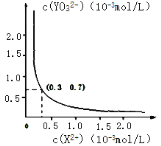
(当离子浓度小于 1×10-5mol·L-1 时,该离子沉淀完全)
(3)若甲能与盐酸反应,生成无色、无味的气体乙.则:
①乙的电子式为_____;
②甲在水中持续加热生成一种更难溶的物质并逸出气体乙,该反应的化学方程式为___。
【答案】第 4 周期 第ⅠA 族4KClO3![]() 3KClO4+KClCaSO35SO2+2MnO4-+2H2O=4H++2Mn2++5SO42-S2->Ca2+0.021
3KClO4+KClCaSO35SO2+2MnO4-+2H2O=4H++2Mn2++5SO42-S2->Ca2+0.021![]() MgCO3 + H2O =Mg(OH)2 + CO2↑
MgCO3 + H2O =Mg(OH)2 + CO2↑
【解析】
(1)含氧酸盐甲的化学式为XYO3,则X为金属,Y为非金属,X、Y的原子序数均不大于20,X的单质能与水发生反应,故元素X为K,X位于Y的下一周期,则元素Y为Cl,元素X为K,K核外电子数为19,有4个电子层,最外层有1个电子,位于周期表中第四周期第ⅠA族;X、Y形成简单离子,其核外电子排布相同,则核大径小,X核电荷数19,Y核电荷数17,故X小于Y;则含氧酸盐甲的化学式为KClO3,KClO3能发生分解反应生成两种盐,一种是含Cl元素的无氧酸盐,由电子、原子守恒可以知道该反应的化学方程式是:4KClO3![]() 3KClO4+KCl ;综上所述,本题答案是:第4周期 第ⅠA 族; 4KClO3
3KClO4+KCl ;综上所述,本题答案是:第4周期 第ⅠA 族; 4KClO3![]() 3KClO4+KCl 。
3KClO4+KCl 。
(2)若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体,则该气体为SO2,此反应为复分解反应,则反应前后元素价态不变,则甲中含S元素且为+4价,根据化合价代数和为0,则XSO3中元素X为+2价,且甲难溶于水,则元素X为Ca,甲为CaSO3,
①由以上分析得,甲为CaSO3,SO2和高锰酸钾发生氧化还原反应,对应的离子方程式为:5SO2+2MnO4-+2H2O=4H++2Mn2++5SO42-;综上所述,本题答案是:CaSO3 ; 5SO2+2MnO4-+2H2O=4H++2Mn2++5SO42-。
②据以上分析可知XYO3为CaSO3,X为Ca,Y为S,形成简单离子,其核外电子排布相同,则核大径小,因此离子半径是S2->Ca2+;因此本题答案是:S2->Ca2+。
③25℃时,由甲在水中的沉淀溶解平衡曲线图可以知道Ksp=0.3×10-3×0.7×10-3=2.1×10-7;若要使溶液X2+离子沉淀完全,则加入YO32-离子的最小浓度为2.1×10-7/1×10-5=2.1×10-2 mol·L-1;因此,本题正确答案是: 0.021。
(3)甲能与盐酸反应,生成无色、无味的气体乙,且甲在水中持续加热生成一种更难溶的物质并逸出气体乙,则甲为MgCO3,乙为CO2,
① CO2 为共价化合物, CO2分子中碳氧原子间形成2对共用电子对,其电子式为:![]() ;因此本题答案是:
;因此本题答案是:![]() 。
。
②甲在水中持续加热生成一种更难溶的物质并逸出CO2气体,该反应的化学方程式为:MgCO3 + H2O =Mg(OH)2 + CO2↑;因此本题答案是:MgCO3 + H2O =Mg(OH)2 + CO2↑。






