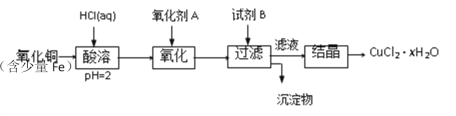
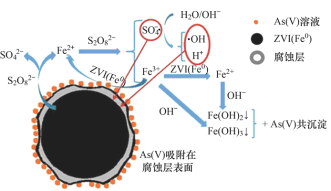
题目内容
【题目】以干海带为原料提取碘单质和氯化钾的过程主要分三步:完成下列填空:
(1)步骤一:灼烧干海带,使其灰化后用热水浸泡、过滤,制得原料液,含有氯化钾等物质。实验室灼烧海带应放在_____________(填写仪器名称)中加热,选用热水而不是冷水浸泡海带灰的目的是____。
(2)步骤二:原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I-,制得富碘溶液。实验室模拟氧化过程的实验装置如图所示。
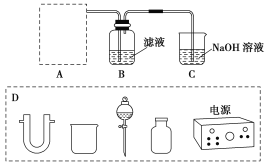
装置中A部分用于制取氯气,实验室制取氯气通常有两种方案:一是在强酸性条件下用氧化剂氧化Cl-;二是电解法。限用图D中的仪器(支撑仪器、导管、导线、石墨棒和橡皮塞除外),能实现的反应是________(选填编号)。
a.2NaCl(s)+MnO2+2H2SO4(浓)加热MnSO4+Cl2↑+Na2SO4+2H2O
b.2KMnO4+16HCl(浓)→2MnCl2+2KCl+5Cl2↑+8H2O
c.2NaCl+2H2O通电2NaOH+Cl2↑+H2↑
d.4HCl(浓)+MnO2加热MnCl2+Cl2↑+2H2O
广口瓶B中发生反应的离子方程式是____________。装置C中NaOH的作用是_______________。
(3)步骤三:取100 mL B中富碘溶液,按如下流程分离碘单质。
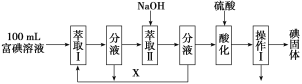
萃取Ⅱ和酸化过程发生的反应分别是:
3I2+6OH-→5I-+IO3-+3H2O;
5I-+IO3-+6H+→3I2+3H2O;
萃取剂X应选择________(选填编号)。
a.100 mL苯 b.10 mL乙醇 c.10 mL CCl4 d.10 mL己烯
实验室进行萃取操作的仪器是________。操作Ⅰ的名称是________。
(4)分离出的KCl样品中常含有少量NaCl和K2CO3等物质,设计实验用沉淀法测定氯化钾样品中K2CO3的质量分数:①要用到的化学试剂是_________(填写化学式);②要测定的物理量是________。
【答案】坩埚 加快溶解速率 bc Cl2+2I-===I2+2Cl- 吸收未反应的氯气,防止污染 c 分液漏斗 过滤 BaCl2或CaCl2 样品质量和干燥沉淀质量
【解析】
(1)灼烧干海带,使其灰化后用热水浸泡、过滤,制得原料液,含有氯化钾等物质。实验室灼烧海带应放在坩埚中加热,选用热水而不是冷水浸泡海带灰的目的是加快溶解速率;
(2)氯气制备一是在强酸性条件下用氧化剂氧化Cl-,实现该反应是常温下发生的氧化还原反应,据此选择实现此条件下的反应,二是电解法。限用图D中的仪器是电解饱和食盐水得到氯气,
a.反应需要加热,没有加热装置,选项a不能实现实验;
b.此反应不需要加热常温下发生反应生成氯气,选项b能实现实验;
c.反应是通电电解氯化钠溶液,是工业氯碱工业原理,选项c能实现实验;
d.反应需要加热,没有加热装置,选项d不能实现实验;
答案选bc;
原料液经结晶过滤分离出氯化钾后,向滤液中通适量氯气氧化I-,制得富碘溶液,广口瓶B中发生反应的离子方程式是Cl2+2I-===I2+2Cl-;过量的氯气不能直接排放到空气中,用装置C中氢氧化钠溶液吸收避免污染;
(3)萃取剂X应选择不溶于水的有机溶剂且碘单质在其中溶解性大,
a.苯不溶于水,碘单质在苯中溶解性大,但100 mL苯的体积和溶液体积相同,萃取碘单质后浓度小,试剂浪费,选项a错误;
b.10 mL乙醇和水溶液混溶,不能分层,不能做萃取剂,选项b错误;
c.10 mL CCl4和水溶液不溶,能分层且碘单质在其中溶解性大,可以做萃取剂,选项c正确;
d.10 mL己烯和碘单质发生加成反应,不能做萃取剂,选项d错误;
答案选c;
萃取分液需要的仪器是分液漏斗、烧杯,分液后加入氢氧化钠溶液发生反应3I2+6OH=5I+IO3-+3H2O,分液得到有机萃取剂重新利用,吸收碘单质的氢氧化钠溶液中加入硫酸酸化,发生反应5I+ IO3-+6H+=3I2+3H2O,操作Ⅰ后得到碘单质固体,说明操作Ⅰ为过滤;
(4)用沉淀法测定氯化钾样品中K2CO3的质量分数,称量一定质量的样品,在烧杯中溶解,加入过量BaCl2或CaCl2溶液,使碳酸根离子生成沉淀,过滤得到沉淀,洗涤、干燥,称量沉淀质量,计算沉淀物质的量,结合碳元素守恒,计算碳酸钾质量,进而得到碳酸钾的质量分数,①要用到的化学试剂是BaCl2或CaCl2;②要测定的物理量是需要测定样品质量和干燥沉淀质量。

 名校课堂系列答案
名校课堂系列答案【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意如下:
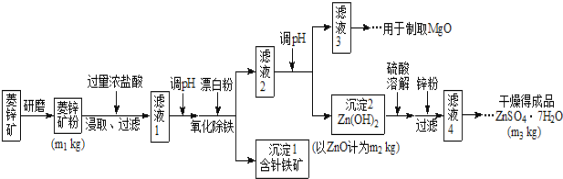
(1)将菱锌矿研磨成粉的目的是_______________________。
(2)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是______________。
(3)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为________________
Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
开始沉淀的pH | 10.4 | 6.4 | — | — |
沉淀完全的pH | 12.4 | 8.0 | — | — |
开始溶解的pH | — | 10.5 | — | — |
工业上从“滤液3”制取MgO过程中,最合适的反应物是______________(选填序号)。
A、大理石粉 B、石灰乳 C、纯碱溶液 D、烧碱溶液
“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(4)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。