��Ŀ����
����Ŀ���ú�������������ͭ��ȡ�Ȼ�ͭ���壨CuCl2��xH2O���������²�����
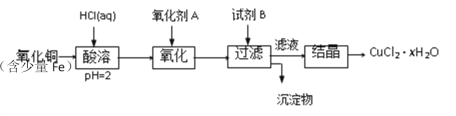
��֪����pHΪ4~5ʱ��Fe3+������ȫˮ���������Cu2+ȴ��ˮ�⡣
(1)�������ܹ����з�����Ӧ�����ӷ���ʽ�У�______
(2)������A��ѡ��_______�����ţ���ͬ��
��Cl2 ��KMnO4 ��HNO3
(3)Ҫ�õ��ϴ��IJ�Ʒ���Լ�B��ѡ��_______
��NaOH ��FeO ��CuO
(4)�Լ�B��������_______
�������Һ��pH �ڽ�����Һ��pH
��ʹFe3+��ȫ���� ��ʹCu2+��ȫ����
(5)����Һ�����ᾧ�õ��Ȼ�ͭ����ķ�����___________����ʵ���Ⱥ�˳�����ţ�
�ٹ��� ������Ũ�� ���������� ����ȴ
(6)Ϊ�˲ⶨ�Ƶõ��Ȼ�ͭ���壨CuCl2��xH2O����xֵ��ij��ȤС�����������ʵ�鷽����
����һ����ȡm g�����������������ټ���Ϊֹ����ȴ������������ˮCuCl2������Ϊn g��
����������ȡm g���塢������������������Һ�����ˡ�����ϴ�Ӻ���С��������������ټ���Ϊֹ����ȴ���������ù��������Ϊn g��
��������������ʵ�鷽����������ȷ�ķ�����______���ݴ˼����x = ______________���ú�m��n�Ĵ���ʽ��ʾ����
���𰸡�Fe + 2H+ �� Fe2+ + H2����CuO + 2H+ �� Cu2+ + H2O �� �� �٢� �ڢܢ� �� 80m-135n/18n
��������
�����ᷴӦ���ɶ��������Ӻ�����������ͭ���ᷴӦ������ͭ���Ӻ�ˮ��д�����ӷ�Ӧ����ʽ��ѡ��������ʱ��Ҫ�ﵽ���������ã��ֲ��������µ����ʣ�Ϊ�˵õ��ϴ��IJ�Ʒ����������Լ����������������ʣ��Լ�B����ǰ�η�Ӧ������Fe3+���ã�ʹ����ȫˮ�⣬���ɳ���������ճ�ʵ���д���Һ�õ�����IJ�������������Ũ������ȴ�ᾧ�����˵õ����壻ֱ�����վ�����в���CuCl2,����ˮ�ⷴӦ������������ù���Ϊ�Ȼ�ͭ������ͭ�Ļ�������ͭԭ���غ㣬�Ȼ�ͭ�����е�ͭ��������ù�������ͭ��ͭԭ�ӵ�������ȣ��г�����ʽ���Ȼ�ͭ���������ͭ����Է�������֮�ȵ�������֮�ȣ������ˮ��ϵ��x���ݴ˷������
(1)�������������£����ɶ��������Ӻ�����������ͭ�����������£����ɶ���ͭ���Ӻ�ˮ�����ӷ�Ӧ����ʽ�ֱ�ΪFe+2H+=Fe2++H2����CuO+2H+=Cu2++H2O��
(2)������������Fe2+����ΪFe3+,���Ҳ������µ��������ӣ�ʹ��KMnO4����K+��Mn2+��ʹ��HNO3����NO3-��������ȥ������������ʱ��������Ӧ�Ժ��������ӣ��������ʣ���ѡ�٣�
(3)Fe3++3H2O![]() Fe(OH)3+3H+,������Լ�BҪ�ܹ���ʹˮ����ȫ���У��ֲ������µ��������ӣ���ʹ��Na0H�����µ�Na+,ʹ��FeO����Fe2+,����Ϊ���壬���pH��ͬʱ�������ͭ���ӣ�û�����������룬��ѡ�ۣ�
Fe(OH)3+3H+,������Լ�BҪ�ܹ���ʹˮ����ȫ���У��ֲ������µ��������ӣ���ʹ��Na0H�����µ�Na+,ʹ��FeO����Fe2+,����Ϊ���壬���pH��ͬʱ�������ͭ���ӣ�û�����������룬��ѡ�ۣ�
(4)ѡ����Լ�B��ͨ������ķ�Ӧ����Cu2+�������Һ��pH����pHΪ4-5ʱ��Fe3+������ȫˮ�������������ʱCu2+ȴ������ˮ�⣬���Դ�ʹ��Fe3+��ȫ��������ѡ�٢ۣ�
(5)����Һ�еõ����壬һ�����������Ũ������ȴ�ᾧ�����ˣ���ʵ����Ⱥ�˳��Ϊ�ڢܢ٣�
(6)ֱ�����վ�����в���CuCl2����ˮ�ⷴӦ�����յõ�CuO��CuCl2�Ļ������²�����ȷ������һ����������ȷ���������ɵ���CuO������ͭԭ���غ�ɵã� ��
��![]() �����
�����![]() ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�