题目内容
常温下,用0.1000 mol/L NaOH溶液分别滴定20.00mL 0.1000 mol/L盐酸和20.00 mL 0.1000 mol/L醋酸溶液,得到2条滴定曲线(如下图所示)以HA表示酸,下列说法正确的是( )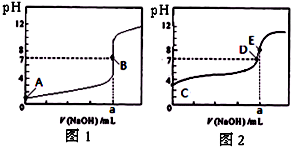
A、滴定盐酸的曲线是图2
B、达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-)
C、达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D、当0mL< V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
B
解析

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
已知下表为250C时某些弱酸的电离平衡常数。下图表示常温时,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。依据所给信息,下列说法正确的是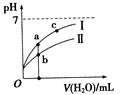
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:
C(Na+)>C(ClO—)>C(CH3COO—)>C(OH—)>C(H+)
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO—+CO2+H2O═2HClO+CO32—
C.a、b、c三点所示溶液中水的电离程度c>a>b
D.图像中,Ⅰ表示CH3COOH,Ⅱ表示HClO,且溶液导电性:c>b>a
欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少
| A.通入二氧化碳气体 | B.加入氢氧化钠固体 |
| C.通入氯化氢气体 | D.加入饱和石灰水溶液 |
已知0.1 mol/L的碳酸氢钠溶液的pH为8.4,则下列说法正确的是( )
| A.加入少量NaOH固体,钠离子和碳酸根离子浓度均增大 |
B.将该溶液加水稀释, 的比值保持不变 的比值保持不变 |
| C.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D.c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) |
下列说法正确的是:
| A.常温下醋酸分子不可能存在于pH>7的碱性溶液中 |
| B.在0.1mol/LNa2SO3的溶液中加入少量NaOH固体,c(Na+)增大,c(SO32﹣)减小 |
| C.0.1mol·L﹣1NH4C1溶液与0.05mol·L﹣1 NaOH溶液等体积混合溶液中离子浓度: c(Cl﹣)>c(NH4+)>c(Na+)>c(OH﹣) |
| D.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN﹣),则a一定小于b |
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.pH=4的醋酸中:c(H+)=4.0mol?L-1 |
| B.饱和小苏打溶液中:c(Na+)= c(HCO3-) |
| C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1 |
X、Y、Z、W、R是原子序数依次增大的五种短周期元素,化合物XZ、Y2W能破坏水的电离平衡,XR能抑制水的电离,则Y元素为
| A.Li | B.F | C.Na | D.S |