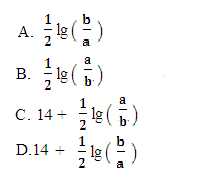题目内容
已知0.1 mol/L的碳酸氢钠溶液的pH为8.4,则下列说法正确的是( )
| A.加入少量NaOH固体,钠离子和碳酸根离子浓度均增大 |
B.将该溶液加水稀释, 的比值保持不变 的比值保持不变 |
| C.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D.c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) |
A
解析试题分析:HCO3-在溶液中存在电离平衡: HCO3- H++CO32-和水解平衡:HCO3-+ H2O
H++CO32-和水解平衡:HCO3-+ H2O OH-+H2CO3。由于0.1 mol/L的碳酸氢钠溶液的pH为8.4,说明在溶液中HCO3-的水解作用大于其电离作用。A. 加入少量NaOH固体,钠离子由于加入而增加,c(OH-)增大,使水解平衡逆向移动,所以碳酸根离子浓度也增大。正确。B.将该溶液加水稀释,c(Na+)减小,c(HCO3-)由于稀释液减小,而且水解平衡正向移动,使其浓度减小的倍数大于稀释的倍数,所以
OH-+H2CO3。由于0.1 mol/L的碳酸氢钠溶液的pH为8.4,说明在溶液中HCO3-的水解作用大于其电离作用。A. 加入少量NaOH固体,钠离子由于加入而增加,c(OH-)增大,使水解平衡逆向移动,所以碳酸根离子浓度也增大。正确。B.将该溶液加水稀释,c(Na+)减小,c(HCO3-)由于稀释液减小,而且水解平衡正向移动,使其浓度减小的倍数大于稀释的倍数,所以 的比值增大。错误。C.根据电荷守恒可的c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-).错误。D.根据物料守恒可得c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)。错误。
的比值增大。错误。C.根据电荷守恒可的c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-).错误。D.根据物料守恒可得c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)。错误。
考点:考查外界条件对HCO3-在溶液中存在电离平衡、水解平衡的影响及物料守恒、电荷守恒在比较离子浓度的应用的知识。

练习册系列答案
相关题目
醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
| A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
| C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
室温下,下列关于pH均为9、体积均为10 mL的NaOH溶液和CH3COONa溶液的说法,正确的是
| A.两种溶液中的c(Na+)相等 |
| B.分别加热到相同温度时,CH3COONa溶液的pH小 |
| C.分别加水稀释到100 mL时,两种溶液的pH依然相等 |
| D.两溶液中由水电离出的c(OH-)之比为10-9/10-5 |
25 ℃时,a mol·L一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是
| A.a=b | B.a>b |
| C.c(A-)=c(Na+) | D.c(A-)<c(Na+) |
相同温度下,在水中分别加入下列物质,若用Kw表示水的离子积,a表示水的电离程度,能使a/Kw的值增大的是
| A.NaOH | B.NaHSO4 | C.HC1 | D.NH4NO3 |
不同温度下,水溶液中c(H+)与c(OH-)的关系如图所示。下列有关说法中正确的是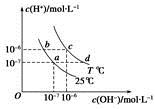
| A.若从a点到c点,可采用在水中加入酸的方法 |
| B.b点对应的醋酸中由水电离的c(H+)=10-6mol·L-1 |
| C.c点对应溶液的Kw大于d点对应溶液的Kw |
| D.T℃时,0.05 mol·L-1的Ba(OH)2溶液的pH=11 |

 M2+(aq)+2OH-(aq),Ksp =a,c(M2+)=bmol·L-1时,溶液的pH等于
M2+(aq)+2OH-(aq),Ksp =a,c(M2+)=bmol·L-1时,溶液的pH等于