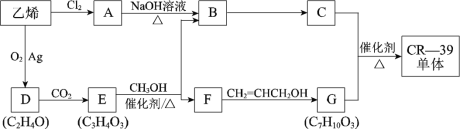
题目内容
【题目】硫酸亚锡(SnSO4)、四氯化锡(SnCl4)常用于印染和电镀工业。某研究小组设计制备SnSO4与SnCl4路线如下。完成下列填空:
(一)制备SnSO4
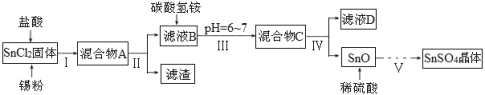
已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化;SnCl2极易水解。
(1)SnCl2用盐酸进行酸溶的原因是_____________________。
(2)步骤Ⅱ中用到的玻璃仪器除烧杯外还有____________;步骤Ⅳ中需要洗涤固体SnO中含有的杂质,检验SnO中的Cl-是否洗涤干净的操作为______________。
(3)步骤Ⅴ依次操作:蒸发浓缩、_________、_________、洗涤、低温干燥,即可得到产物。
(二)制备SnCl4
实验室用熔融的金属锡与干燥纯净的氯气制取无水SnCl4(SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解),此反应过程放出大量的热。实验装置如图所示:
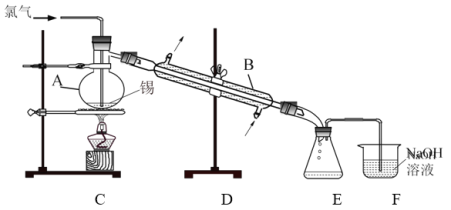
(4)仪器B的名称______________。
(5)图中尾气处理装置不够完善,改进的方法是:________________(可以画图,也可以用文字表述,需注明仪器、试剂及连接位置等)。
(6)若反应中用去锡粉11.9 g,反应后在锥形瓶中收集到23.8 g SnCl4,则SnCl4的产率为__________。
【答案】抑制Sn2+的水解 漏斗、玻璃棒 取最后一次洗涤液,加入硝酸酸化的AgNO3溶液,如果没有出现沉淀,说明洗涤干净,如果出现沉淀,说明没有洗涤干净 冷却结晶 过滤 冷凝管 E、F之间连装有碱石灰的干燥管 91.2%
【解析】
由于Sn2+易水解、易被氧化,加入盐酸,抑制Sn2+水解,加入Sn粉可以与盐酸反应,调节溶液pH,还防止Sn2+被氧化,步骤Ⅱ为过滤,得SnCl2溶液,向其中加碳酸氢铵,调节溶液pH=6~7,使Sn元素以SnO形式沉淀,再过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,蒸发浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体,滤液D中含有大量的NH4Cl等,据此分析;
(一)(1)加入盐酸,抑制Sn2+水解;
(2)步骤Ⅱ为过滤;沉淀为SnO表面附着Cl-,要想检验滤渣是否洗涤干净,用硝酸、硝酸银溶液检验最后一次洗涤液中是否含有Cl-;
(3)步骤Ⅴ是用硫酸溶解后,从溶液中获得晶体,滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,制得SnSO4晶体;
(二)(1)仪器B的名称为冷凝管;
(2)由信息可知SnCl4遇水水解,F中氢氧化钠溶液中水蒸气易挥发进入E中;
(3)根据产率=![]() ×100%,据此解答即可。
×100%,据此解答即可。
(一)(1)SnCl2是强酸弱碱盐,在溶液中Sn2+易发生水解反应使溶液显酸性。加入盐酸,抑制Sn2+水解;
②步骤Ⅱ为过滤,用到的玻璃仪器除烧杯外还有漏斗、玻璃棒,步骤IV是分离难溶性固体与溶液的方法,是过滤,步骤Ⅳ中需要洗涤固体SnO中含有的杂质,检验SnO中的Cl-是否洗涤干净,使用的试剂是硝酸、硝酸银溶液,具体方案为:取最后一次洗涤液,加入硝酸酸化的硝酸银,如果没有出现沉淀,说明洗涤干净,如果出现沉淀,说明没有洗涤干净;
(3)步骤Ⅴ是用硫酸溶解SnO后,得到SnSO4溶液,从溶液中获得晶体,滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,制得SnSO4晶体;
(二)(1)根据仪器结构可知仪器B为冷凝管;
(2)E收集产品,F中氢氧化钠溶液中水蒸气易挥发,沿导气管进入E中,易使SnCl4水解,所以改进的措施是在E和F之间增加干燥装置可以避免此种情况发生;
(3)11.9 g Sn粉的物质的量n(Sn)=![]() =0.1 mol,故根据Sn元素守恒可知应生成SnCl4极的物质的量为0.1 mol,其质量m(SnCl4)=0.1 mol×(119+4×35.5) g/mol=26.1 g,其产率=
=0.1 mol,故根据Sn元素守恒可知应生成SnCl4极的物质的量为0.1 mol,其质量m(SnCl4)=0.1 mol×(119+4×35.5) g/mol=26.1 g,其产率=![]() ×100%≈91.2%。
×100%≈91.2%。