题目内容
16.下列实验用来证明SO2的存在,其中正确的是( )| A. | 不能使品红褪色 | |
| B. | 能使湿润的蓝色石蕊试纸变红 | |
| C. | 通入足量的NaOH溶液中,再滴入BaCl2溶液有白色沉淀生成,该沉淀溶于稀盐酸 | |
| D. | 通入稀溴水中能使溴水褪色,得澄清溶液,再滴加Ba(NO3)2溶液有白色沉淀,该沉淀不溶于硝酸 |
分析 一定有SO2存在,可利用二氧化硫的漂白性或还原性来证明,而不能利用酸性氧化物的性质来证明,以此来解答.
解答 解:A、不能使品红褪色,说明没有二氧化硫的存在,故A错误;
B、酸性气体都能使湿润的蓝色石蕊试纸变红,如二氧化碳等,故B错误;
C、通入足量的氢氧化钠溶液,再加BaCl2溶液有白色沉淀产生,该沉淀能溶于稀盐酸,沉淀可能为碳酸钡,气体可能为二氧化碳,故C错误;
D、通入溴水,溴水褪色,再加入Ba(NO3)2溶液有白色沉淀生成,白色沉淀为硫酸钡,则使溴水褪色的气体为二氧化硫,二氧化硫与溴水发生氧化还原反应,故D正确;
故选D.
点评 本题考查二氧化硫的性质,解决其类型的题目要把握二氧化硫与二氧化碳的性质相似之处混合差异为解答的关键,B、C为解答的易错点,注意二氧化硫漂白为暂时性的,题目难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
6.一定温度下,反应:N2(g)+3H2(g)?2NH3(g),达到化学平衡状态的标志是( )
| A. | c(N2)﹕c(H2)﹕c(NH3)=1﹕3﹕2 | |
| B. | N2,H2和NH3的质量分数不再改变 | |
| C. | N2与H2的物质的量之和是NH3的物质的量的2倍 | |
| D. | 单位时间内每增加1mol N2,同时增加3mol H2 |
7.一定条件下,X(g)+3Y(g)?2Z(g)达到化学平衡的标志是( )
| A. | Z的分解速率和生成速率相等 | |
| B. | X、Y、Z的浓度不再变化 | |
| C. | 反应体系的总质量保持不变 | |
| D. | 单位时间内生成nmolZ,同时生成nmolX |
1.在一定温度下,可逆反应A(气)+3B(气)?2C(气)达到平衡的标志是( )
| A. | 2v正(A)=v正(C) | |
| B. | 单位时间内生成n摩A,同时生成3n摩B | |
| C. | A、B、C的浓度不再变化 | |
| D. | A、B、C的分子数之比为1:3:2 |
8.分子式为C8H16O2的有机物A,它能在酸性条件下水解生成B和C,在一定条件下B能转化成C.下列说法正确的是( )
| A. | 有机物B的红外线谱图出现C=O键的振动吸收 | |
| B. | 有机物C的核磁共振氢谱有可能是三个吸收峰 | |
| C. | 有机物A的结构可能有4种 | |
| D. | 有机物C可以发生缩聚反应 |
5.下列过程中化学反应速率的加快对人类有益的是( )
| A. | 金属的腐蚀 | B. | 食物的腐败 | C. | 塑料的老化 | D. | 氨的合成 |
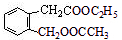 ,D的名称是乙醇.
,D的名称是乙醇.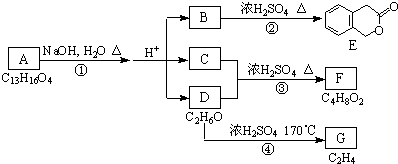
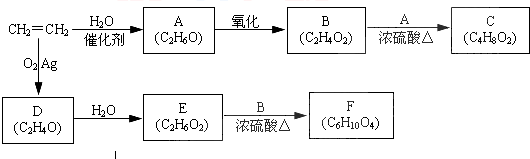
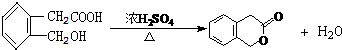 .
.
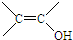 、
、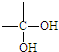 结构非常不稳定,会迅速转变为
结构非常不稳定,会迅速转变为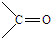
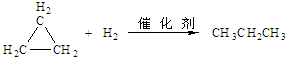
 .
.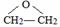 .
.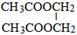 .
.