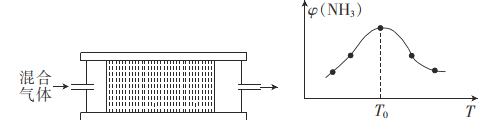
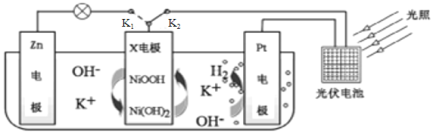
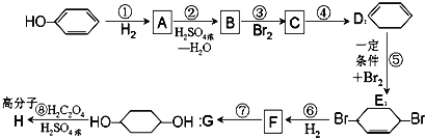
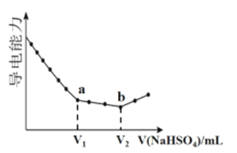
题目内容
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。其变化可表述为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。
(1)请分析该反应中电子转移的情况___。(双线桥法表示)
(2)浓盐酸在反应中显示出来的性质是___(填写编号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,则转移的电子的物质的量为___mol。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的___倍(保留小数点后两位)。
【答案】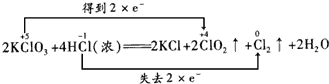 ② 0.2 2.63
② 0.2 2.63
【解析】
(1)KClO3中Cl元素的化合价从+5价降低到+4价,HCl中Cl元素的化合价从-1价升高到0价,据此分析解答;
(2)根据HCl中部分氯元素化合价由-1价升高为Cl2中0价,还有部分氯元素化合价不变分析判断;
(3)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,据此计算转移电子物质的量;
(4)根据单位质量的消毒剂得到电子的物质的量大小计算。
(1)KClO3中Cl元素的化合价从+5价降低到+4价,得2×1=2个电子,HCl中Cl元素的化合价从-1价升高到0价,失去2×1=2个电子,则电子转移的方向和数目为 ,故答案为:
,故答案为: ;
;
(2)反应2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,HCl中氯元素化合价由-1价升高为Cl2中0价可知,HCl中氯元素被氧化,还有部分氯元素化合价不变,这部分HCl在反应中起到酸的作用,故答案为:②;
(3)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,所以产生0.1molCl2,转移的电子的物质的量为0.1mol×2=0.2mol.故答案为:0.2;
(4)假设质量都是mg,ClO2→Cl-得5个电子,Cl2→2Cl-得2个电子,所以ClO2得到的电子的物质的量为![]() ×5=
×5=![]() mol,Cl2得到的电子的物质的量为
mol,Cl2得到的电子的物质的量为![]() ×2=
×2=![]() mol,所以
mol,所以![]() ∶
∶![]() =2.63倍,故答案为:2.63。
=2.63倍,故答案为:2.63。

【题目】甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
(1)已知 ①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) ΔH= + 93.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
③甲醇的燃烧热为726.51kJ·mol-1。
要写出表示甲醇燃烧热的热化学方程式,还缺少的热化学方程式为________________。
(2)甲醇可采用煤的气化、液化制取(CO+2H2CH3OH ΔH<0)。在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与![]() 的关系如图所示。
的关系如图所示。
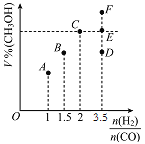
①当起始![]() =2,经过5min达到平衡,0~5min内平均反应速率v(H2)=0.1molL-1min-1,则该条件CO的平衡转化率为_____;若其它条件不变,在T2℃(T2>T1)下达到平衡时CO的体积分数可能是____(填标号)
=2,经过5min达到平衡,0~5min内平均反应速率v(H2)=0.1molL-1min-1,则该条件CO的平衡转化率为_____;若其它条件不变,在T2℃(T2>T1)下达到平衡时CO的体积分数可能是____(填标号)
A.<![]() B.=
B.=![]() C.
C.![]() ~
~ ![]() D.=
D.=![]() E.>
E.> ![]()
②当![]() =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的____点选填“D”、“E”或“F”)。
=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的____点选填“D”、“E”或“F”)。
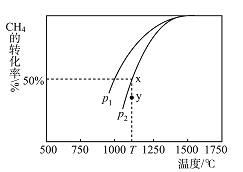
(3)制甲醇的CO和H2可用天然气来制取:CO2(g)+CH4(g)2CO(g)+2H2(g)。在某一密闭容器中有浓度均为0.1mol·L1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则该反应的ΔH______(选填“大于”“小于”或“等于”)0。压强p1_______(选填“大于”或“小于”)p2。当压强为p2时,在y点:v(正)__________(选填“大于”“小于”或“等于”)v(逆)。若p2=6Mpa,则T℃时该反应的平衡常数Kp=_____MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)研究表明:CO2和H2在一定条件下也可以合成甲醇,反应方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g) [反应Ⅰ]。
①一定条件下,往2L恒容密闭容器中充入2.0mol CO2和4.0mol H2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如下图所示,其中活化能最高的反应所用的催化剂是____(填“A”、“B”或“C”)。

②在某催化剂作用下,CO2和H2除发生反应①外,还发生如下反应CO2(g)+H2(g)CO(g)+H2O(g)[反应Ⅱ]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:
T(K) | CO2实际转化率(%) | 甲醇选择性(%) |
543 | 12.3 | 42.3 |
553 | 15.3 | 39.1 |
注:甲醇的选择性是指发生反应的CO2中转化为甲醇的百分比。
表中数据说明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是_________。