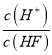题目内容
【题目】氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前研究的热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式:CH4(g)+2H2O(g)![]() CO2(g)+4H2(g)△H=+165.0kJ·mol-1。
CO2(g)+4H2(g)△H=+165.0kJ·mol-1。
已知反应器中存在如下反应过程式:
Ⅰ.CH4(g)+H2O(g)CO(g)+3H2(g) ΔH1=+206. 4 kJ. mol-1
Ⅱ.CO(g)+H2O(g)CO2(g)+H2(g) H2=___。
(2)某温度下,4molH2O和1 mol CH4在体积为2L的刚性容器内同时发生反应I、Ⅱ,反应达到平衡时,体系中n(CO)=bmol、n(CO2)=dmol,则该温度下反应I的平衡常数K的值为_____用含字母b、d的代数式表示)
(3)欲增大CH4转化为H2的平衡转化率,可采取的措施有_____(填标号)。
A.适当增大反应物的投料比n(H2O):n(CH4)
B.增大压强
C.分离出CO2
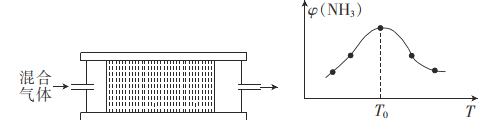
(4)H2用于工业合成氨:N2+3H2![]() 2NH3.将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器中反应,反应器的温度变化与从反应器排出的气体中NH3的体积分数φ(NH3)的关系曲线如图,反应器温度高于T0后,NH3的体积分数g(NH3)随温度的升高而减小的原因是____。
2NH3.将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器中反应,反应器的温度变化与从反应器排出的气体中NH3的体积分数φ(NH3)的关系曲线如图,反应器温度高于T0后,NH3的体积分数g(NH3)随温度的升高而减小的原因是____。
某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始时气体总压为p0Pa,平衡时气体总压为0.9p0Pa,则H2的转化率为____,气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学反应平衡常数(记作Kp),则此温度下,该反应的化学平衡常数Kp=_____(用含p0的代数式表示)。
【答案】-41.4 kJ. mol-1 ![]() AC 温度高于T0时反应达到平衡,该反应是正反应放热反应,故温度升高,平衡逆向移动,NH3的体积分数减小 20%
AC 温度高于T0时反应达到平衡,该反应是正反应放热反应,故温度升高,平衡逆向移动,NH3的体积分数减小 20% ![]()
【解析】
(1)利用盖斯定律求出反应Ⅱ的H2;
(2)求出平衡时反应物、生成物的浓度,计算平衡常数;
(3)欲增大CH4转化为H2的平衡转化率,当CH4投料时的物质的量不变,使化学平衡正向移动;
(4)温度低于T0时未达到平衡,温度高于T0时反应达到平衡,该反应是放热反应,根据题意计算出各自的分压,然后计算分压平衡常数。
(1)由盖斯定律可知,H2=△H-ΔH1=165.0kJ·mol-1-206. 4 kJ· mol-1=-41.4 kJ· mol-1;
(2)由n(CO2)=dmol可知反应Ⅱ生成的n(H2)=dmol,同时消耗n(CO)=dmol,同时消耗n(H2O)= dmol,则反应Ⅰ中生成的n(CO)=(b+d)mol,消耗的n(CH4)=(b+d)mol,消耗的n(H2O)=(b+d)mol,生成的n(H2)= (3b+3d)mol,则平衡体系内n(CH4)=(1-b-d) mol、n(H2O)=(4-b-2d)mol、n(CO)=bmol、n(H2)= (3b+4d)mol,,容器的体积为2L,故反应I的平衡常数K=
![]()
![]() =
=![]() ;
;
(3)A.适当增大反应物的投料比n(H2O):n(CH4),增大水的量促进甲烷转化为CO,促进CO转化为CO2,A正确;
B.增大压强,反应Ⅰ的平衡向左移动,B错误;
C.分离出CO2可使平衡向右移动,C正确;
答案选AC。
(4)温度低于T0时未达到平衡,温度升高,反应速率加快,NH3的体积分数增大,温度高于T0时反应达到平衡,该反应是正反应放热反应,故温度升高,平衡常数减小,NH3的体积分数减小;
设初始加入n(N2)=amol,n(H2)=3amol,平衡时H2的转化率为x,则反应中消耗的H2的物质的量为3axmol,反应中消耗的N2的物质的量为axmol,生成NH3的物质的量为2axmol,则达到平衡时,H2的物质的量为(3a -3ax)mol,N2的物质的量为(a -ax)mol,NH3的物质的量为2axmol,在恒温恒容的容器中压强之比等于物质的量之比,故4a:(4a-2ax)= p0:0.9p0,x=20% ,所以平衡时H2的物质的量为2.4amol,N2的物质的量为0.8amol,NH3的物质的量为0.4amol,则它们各自的分压分别为:p (H2)= 0.9p0Pa×[2.4a/(2.4a+0.8a+0.4a)]=0.6 p0Pa,p (N2)= 0.9p0Pa×[0.8a/(2.4a+0.8a+0.4a)]=0.2p0Pa,p (NH3)= 0.9p0Pa×[0.4a/(2.4a+0.8a+0.4a)]
=0.1p0Pa,该反应的化学平衡常数Kp= ![]() 。
。

【题目】辉铜矿(主要成分Cu2S)作为铜矿中铜含量最高的矿物之一,可用来提炼铜和制备含铜化合物。
Ⅰ.湿法炼铜用Fe2(SO4)3溶液作为浸取剂提取Cu2+:
(1)反应过程中有黄色固体生成,写出反应的离子方程式______________________。
(2)控制温度为85℃、浸取剂的pH = 1,取相同质量的辉铜矿粉末分别进行如下实验:
实验 | 试剂及操作 | 3小时后Cu2+浸出率(%) |
一 | 加入10mL 0.25mol·L-1Fe2(SO4)3溶液和5 mL水 | 81.90 |
二 | 加入10 mL0.25mol·L-1Fe2(SO4)3溶液和5mL 0.1mol·L-1H2O2 | 92.50 |
回答:H2O2使Cu2+浸出率提高的原因可能是__________。
(3)实验二在85℃后,随温度升高,测得3小时后Cu2+浸出率随温度变化的曲线如图。Cu2+浸出率下降的原因_________________。

(4)上述湿法炼铜在将铜浸出的同时,也会将铁杂质带进溶液,向浸出液中通入过量的O2并加入适量的CuO,有利于铁杂质的除去,用离子方程式表示O2的作用_________。解释加入CuO的原因是_____。
Ⅱ.某课题组利用碳氨液((NH4)2CO3、NH3·H2O)从辉铜矿中直接浸取铜。

其反应机理如下:
①Cu2S(s)2Cu+(aq) +S2-(aq) (快反应)
②4Cu++O2+2H2O4Cu2++4OH- (慢反应)
③Cu2++4NH3·H2OCu(NH3)42++4H2O(快反应)
(5)提高铜的浸出率的关键因素是 ________。
(6)在浸出装置中再加入适量的(NH4)2S2O8,铜的浸出率有明显升高,结合平衡移动原理说明可能的原因是__________。
【题目】某蓄电池的反应为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2。
Fe(OH)2+Ni(OH)2。
(1)该蓄电池放电时,发生还原反应的物质是________;
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,或与该蓄电池的_____ (填“正”或“负”)极相连。
(3)精炼铜时,粗铜应与直流电源的________(填“正”或“负”)极相连。精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。甲同学设计如下除杂方案:
![]()
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀时的pH | 2.3 | 7.5 | 5.6 |
完全沉淀时的pH | 3.9 | 9.7 | 6.4 |
①实验操作I的名称________ 则加入H2O2的目的是____________________。
②乙同学认为应将方案中的pH调节到8,你认为此观点_____(填“正确”或“不正确”),理由是_________。
(4)该蓄电池充电时阴极的电极反应式为_________________。