题目内容
14.根据构造原理下列关于7号元素的基态原子的电子排布式正确的是( )| A. | 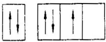 | B. | 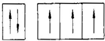 | C. | 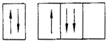 | D. | 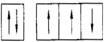 |
分析 根据原子核外电子排布原则:电子优先单独占据1个轨道,且自旋方向相同时能量最低,据此判断7号元素基态电子的轨道表示式.
解答 解:由于能级相同的轨道中电子优先单独占据1个轨道,且自旋方向相同,原子的能量最低,则7号元素氮原子基态电子的轨道表示式为: ,故选:B.
,故选:B.
点评 本题考查了原子轨道表示式的书写方法,题目难度中等,明确原子基态电子的轨道排布式中电子优先单独占据1个轨道,且自旋方向相同时能量最低.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案
相关题目
4.同温同压下,相同体积的氦气(${\;}_{2}^{4}$He)和氘气(${\;}_{1}^{2}$H2)不相等的是( )
| A. | 分子数 | B. | 原子数 | C. | 中子数 | D. | 电子数 |
2.下列说法中正确的是( )
| A. | NO2、SO2、BF2、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 | |
| B. | P4和CH4都是正四面体分子且键角都为109°28ˊ | |
| C. | NaCl晶体中与每个Na+距离相等且最近的Na+共有8个 | |
| D. | 单质的晶体中一定不存在的微粒是阴离子 |
9.已知有关物质的熔、沸点数据如下:
请参考上述数据回答下列问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法产生铝.为什么不用电解MgO的方法生产镁;也不用电解AlCl3的方法生产铝?答MgO的熔点太高,电解MgO消耗能量多,经济效益低;AlCl3晶体为分子,在熔融状态不电离、不导电,不能被电解.
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实实验方法是将两种晶体加热到熔化状态,MgCl2能导电而AlCl3不能导电,故证明MgCl2为离子晶体,AlCl3为分子晶体.
| MgO | AlO3 | MgCl2 | AlCl3 | |
| 熔点/℃ | 2852 | 2072 | 714 | 190(2.5×105Pa) |
| 沸点/℃ | 3600 | 2980 | 1412 | 182.7 |
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法产生铝.为什么不用电解MgO的方法生产镁;也不用电解AlCl3的方法生产铝?答MgO的熔点太高,电解MgO消耗能量多,经济效益低;AlCl3晶体为分子,在熔融状态不电离、不导电,不能被电解.
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实实验方法是将两种晶体加热到熔化状态,MgCl2能导电而AlCl3不能导电,故证明MgCl2为离子晶体,AlCl3为分子晶体.
19.下列物质中与钠、苛性钠、小苏打均能发生反应的是( )
| A. | 乙醇 | B. | 苯酚 | C. | 乙酸 | D. | 乙醛 |
6.分别在pH=1的酸和pH=14的NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是( )
①两溶液的体积相同,酸是多元强酸
②两溶液的体积相同,酸是一元弱酸
③酸溶液的体积大于NaOH溶液的体积
④酸是强酸,浓度比NaOH溶液的大.
①两溶液的体积相同,酸是多元强酸
②两溶液的体积相同,酸是一元弱酸
③酸溶液的体积大于NaOH溶液的体积
④酸是强酸,浓度比NaOH溶液的大.
| A. | ①② | B. | ② | C. | ②③ | D. | ④ |
3.下列物质中,属于新型无机非金属材料的是( )
| A. | 有色玻璃 | B. | 碳化硅陶瓷 | C. | 石英玻璃 | D. | 钢化玻璃 |
4.某研究小组为探究氯酸钾受热分解反应中的催化剂效果,在相同条件下,使用不同催化剂测量产生等量气体时所需时间,并回收催化剂,结果如下:
(1)根据实验原理,所选仪器带铁夹的铁架台、大试管(含带橡皮塞的导管)、量气装置、过滤装置、电子天平外,还必需的仪器有酒精灯、计时器(或秒表).
(2)写出实验①的化学方程式2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,根据表中信息,若实验室中无MnO2可选用上述催化剂中的Fe2O3(填化学式)代替也可基本达到同样的催化效果.
(3)实验②中的KClO3分解率为40.8%(保留一位小数).
(4)实验④中发现有刺激性气味的气体单质产生,请完成以下探究活动:
| 实验编号 | KCIO3(g) | 催化剂 | 产生气体(mL) (已折算到标准情况) | 耗时(S) | ||
| 化学式 | 质量(g) | 回收 | ||||
| ① | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| ② | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| ③ | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| ④ | 0.60 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
(2)写出实验①的化学方程式2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,根据表中信息,若实验室中无MnO2可选用上述催化剂中的Fe2O3(填化学式)代替也可基本达到同样的催化效果.
(3)实验②中的KClO3分解率为40.8%(保留一位小数).
(4)实验④中发现有刺激性气味的气体单质产生,请完成以下探究活动:
| 提出猜想 | 该刺激性气味的气体单质可能是Cl2 |
| 设计实验 验证猜想 | 实验步骤和结论(不要求写具体操作过程)将燃着的小木条插进集气瓶中,直至木条熄灭,用玻璃棒粘着湿润的碘化钾淀粉试纸插进集气瓶中.若试纸变蓝则证明是Cl2,否则不是氯气: |