题目内容
6.分别在pH=1的酸和pH=14的NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是( )①两溶液的体积相同,酸是多元强酸
②两溶液的体积相同,酸是一元弱酸
③酸溶液的体积大于NaOH溶液的体积
④酸是强酸,浓度比NaOH溶液的大.
| A. | ①② | B. | ② | C. | ②③ | D. | ④ |
分析 在本题中,酸电离出的 C(H+)=0.1mol/L,碱液中 C(OH-)=1 mol/L,铝是足量的,所以生成氢气的量就取决于 n(H+)、n(OH-),而根据铝与酸碱的反应可知,当生成相同量的氢气时,需要的 n(H+) 比 n(OH-)多,所以当酸生成的氢气更多时,就需要 n(H+)>n(OH-),然后结合强酸完全电离,弱酸部分电离的特点来解本题.
解答 解:由铝与酸、碱的反应可知:
2Al~6H+~3H2 2Al~2OH-~3H2
要使生成的氢气前者多,必须n(H+)>n(OH-)
①当酸为多元强酸,由于C(H+)<C(OH-),当两种溶液体积相同时,则会有n(H+)<n(OH-),不符合题意,故①错误;
②若酸是一元弱酸,虽然酸电离出的 C(H+)小于氢氧化钠中的 C(OH-),但弱酸是部分电离,此时酸中的H+ 的总量完全可以比 NaOH 中的 OH- 多 故满足n(H+)>n(OH-),符合题意,故②正确;
③pH=1的酸中c(H+)=0.1mol/L,pH=14的NaOH溶液c(OH-)=1mol/L,若酸溶液的体积大于NaOH溶液30倍,定有n(H+)>3n(OH-),不管强酸和弱酸,故③正确,
④pH=1的酸中c(H+)=0.1mol/L,pH=14的NaOH溶液c(OH-)=1mol/L,若酸为强酸,则浓度不可能比NaOH溶液大,与题意矛盾,故④错误;
故选C.
点评 此题考查PH定义,强电解质和弱电解质的区别,铝单质的化学性质,其中强电解质和弱电解质的区别是难点,综合性较强,难度适中.

练习册系列答案
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
17.实验室保存下列试剂,有错误的是( )
| A. | 浓盐酸易挥发,盛在无色密封的玻璃瓶中 | |
| B. | 氟化氢有剧毒,保存在有塑料盖的玻璃瓶中 | |
| C. | 液溴易挥发,盛放在用水封的棕色瓶中 | |
| D. | 碘易升华,保存在棕色瓶中 |
1.随着医用高分子材料的发展,人们用人工器官代替不能治愈的病变器官.目前人们已经制成的人工器官有( )①心脏 ②皮肤 ③骨骼 ④肝 ⑤肾 ⑥眼 ⑦喉.
| A. | ①②③ | B. | ①②⑥ | C. | ②③⑥ | D. | 全部 |
18.我国农业因遭受酸雨而造成每年损失高达15亿多元.为了有效控制酸雨,目前国务院已批准《酸雨控制区和二氧化硫污染控制区划分方案》等法规.
(1)现有雨水样品一份,每隔一段时间测定该雨水样品的pH,得数据如下:
分析数据,回答下列问题:
①雨水样品的pH变化的原因是(用化学反应方程式表示)2H2SO3+O2=2H2SO4.
②如果将刚取样的上述雨水和自来水相混合,pH将变小,原因是(用化学反应方程式表示)SO2+2H2O+Cl2=H2SO4+2HCl.
(2)你认为减少酸雨产生的途径可采用的措施是C
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③B.②③④⑤C.①③⑤D.①③④⑤
(3)在英国进行的一个研究结果表明:高烟囱可以有效地降低地表面SO2浓度.在20世纪的60~70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建筑高烟囱的结果,地面SO2浓度降低了30%之多.请你从全球环境保护的角度,分析这种方法是否可取?阐述其理由.
(1)现有雨水样品一份,每隔一段时间测定该雨水样品的pH,得数据如下:
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
①雨水样品的pH变化的原因是(用化学反应方程式表示)2H2SO3+O2=2H2SO4.
②如果将刚取样的上述雨水和自来水相混合,pH将变小,原因是(用化学反应方程式表示)SO2+2H2O+Cl2=H2SO4+2HCl.
(2)你认为减少酸雨产生的途径可采用的措施是C
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③B.②③④⑤C.①③⑤D.①③④⑤
(3)在英国进行的一个研究结果表明:高烟囱可以有效地降低地表面SO2浓度.在20世纪的60~70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建筑高烟囱的结果,地面SO2浓度降低了30%之多.请你从全球环境保护的角度,分析这种方法是否可取?阐述其理由.
16.下列说法正确的是( )
| A. | 任何化学反应都伴有能量变化 | |
| B. | 化学反应中的能量变化都表现为热量变化 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 反应物的总能量高于生成物的总能量时,发生吸热反应 |

 (其中:-X、-Y均为官能团).
(其中:-X、-Y均为官能团).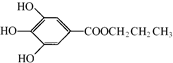 .
.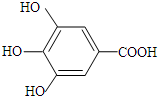 +NaHCO3→
+NaHCO3→ +H2O+CO2↑.
+H2O+CO2↑.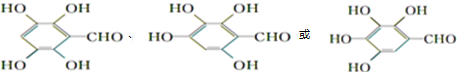 .
.