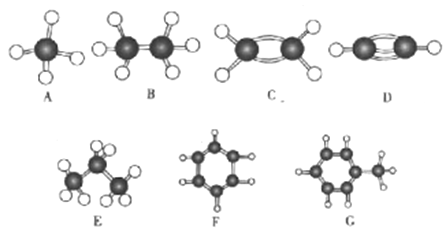
题目内容
【题目】铅的冶炼过程大致如下:![]() 富集:将方铅矿
富集:将方铅矿![]() 进行浮选;
进行浮选;![]() 焙烧:
焙烧:![]()
![]()
![]() ;
;![]() 制粗铅:
制粗铅:![]()
![]()
![]() ,
,![]()
![]()
![]() 。下列说法正确的是:
。下列说法正确的是:
A.浮选法富集方铅矿的过程发生化学变化
B.将![]() 冶炼成Pb理论上至少需要
冶炼成Pb理论上至少需要![]()
C.整个冶炼过程中,制取![]() 共转移
共转移![]() 电子
电子
D.方铅矿焙烧的反应中,PbS是还原剂,还原产物只有PbO
【答案】B
【解析】
A. 没有生成新物质生成的变化为物理变化,有新物质生成的变化为化学变化;
B. 将1molPbS冶炼成Pb的过程中,根据方程式可知2PbS~2PbO~C~2Pb,根据Pb和C之间的关系式计算C的质量;
C. 根据元素化合价变化计算转移电子的物质的量;
D. 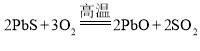 中S元素化合价由-2价变为+4价,O元素化合价由0价变为-2价,得电子且化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,氧化剂对应的产物是还原产物;
中S元素化合价由-2价变为+4价,O元素化合价由0价变为-2价,得电子且化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,氧化剂对应的产物是还原产物;
A. 浮选法富集方铅矿的过程中没有新物质生成,属于物理变化, A项错误;
B. 将1molPbS冶炼成Pb的过程中,根据方程式得出:2PbS~2PbO~C~2Pb,1molPbS冶炼成Pb理论上至少需要0.5mol的碳,即需要6g碳, B项正确;
C. 整个冶炼过程中,1molPbS转化为1molPbO转移电子是6mol,1molPbO转化为1molPb转移电子是2mol,所以制取1molPb共转移8mol电子, C项错误;
D.方铅矿焙烧反应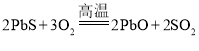 中,PbS中硫元素化合价升高,是还原剂,氧元素化合价降低,还原产物有PbO和SO2, D项错误;
中,PbS中硫元素化合价升高,是还原剂,氧元素化合价降低,还原产物有PbO和SO2, D项错误;
答案选B。

 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献,他以饱和食盐水、![]() 、
、![]() 为原料先制得
为原料先制得![]() ,进而生产出纯碱。回答下列问题:某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示
,进而生产出纯碱。回答下列问题:某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示![]() 图中夹持、固定用的仪器未画出
图中夹持、固定用的仪器未画出![]() 。
。
![]() 乙装置中的试剂是___________。丁装置中稀硫酸的作用是_________________。
乙装置中的试剂是___________。丁装置中稀硫酸的作用是_________________。
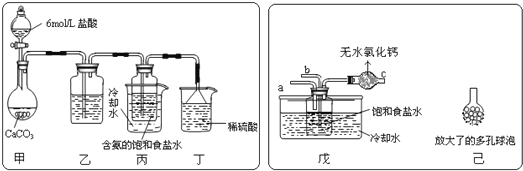
![]() 另一位同学用图中戊装置
另一位同学用图中戊装置![]() 其他装置未画出
其他装置未画出![]() 进行实验。实验时,须先从______管通入_____气体。
进行实验。实验时,须先从______管通入_____气体。
![]() 有同学建议在戊装置的b管下端连接己装置,理由是________________。
有同学建议在戊装置的b管下端连接己装置,理由是________________。
![]() 下表中所列出的是相关物质在不同温度下的溶解度数据
下表中所列出的是相关物质在不同温度下的溶解度数据![]() 水
水![]() :
:
0 | 10 | 20 | 30 | 40 | 50 | |
NaCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
参照表中数据,请分析丙、戊装置中使用冷却水或者冰水的原因:____________。
![]() 该小组同学为了测定丙中所得晶体的碳酸氢钠的纯度
该小组同学为了测定丙中所得晶体的碳酸氢钠的纯度![]() 假设晶体中不含碳酸盐杂质
假设晶体中不含碳酸盐杂质![]() ,将晶体充分干燥后,称量质量为
,将晶体充分干燥后,称量质量为![]() 。再将晶体加热到质量不再变化时,称量所得粉末质量为
。再将晶体加热到质量不再变化时,称量所得粉末质量为![]() 。然后进行下图所示实验:
。然后进行下图所示实验:
![]()
①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是______![]() 填字母
填字母![]() 。
。
a.在加入氯化钙溶液后,振荡、静置,向上层清液中继续加入少量氯化钙溶液
b.在加入氯化钙溶液后,振荡、静置,向上层清液中再加入少量碳酸钠溶液
c.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②所得晶体中碳酸氢钠的纯度为_______________。
【题目】向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
操作 | 现象 | 结论 | |
A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有 |
B | 滴加氯水和CCl4,振荡,静置 | 下层溶液显紫色 | 原溶液中有I- |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试管不变蓝 | 原溶液中无 |
A.AB.BC.CD.D