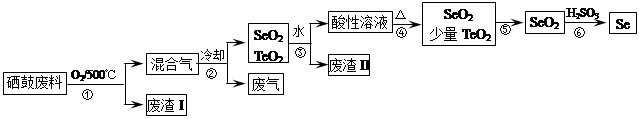题目内容
氨基甲酸铵是一种用途广泛的化工原料。有关它的资料如下:①常温下,在干燥的空气中稳定,遇水或潮湿空气则生成碳酸铵或碳酸氢铵;②熔点58℃,59℃则可分解成NH3和CO2气体;③在密封管内加热至120℃~140℃时失水生成尿素[CO(NH2)2];④酸性溶液中迅速分解;⑤合成氨基甲酸铵原理为:

(1)写出氨基甲酸铵在密封管内加热至120°C~140°C生成尿素的反应方程式:_______________
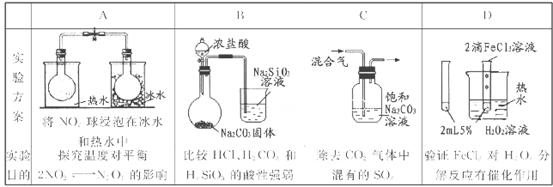
(2)仪器B名称________;盛放药品是: ________;
(3)合成氨基甲酸铵的反应在一定条件下能自发进行,该反应的反应热ΔH_____0(填“>” “=”或“<”)
(4)有同学建议该CO2发生装置直接改用“干冰”,你认为他的改进有何优点:(回答二点)
①________________;②________________
(5)该实验装置中有明显导致实验失败的隐患有:(指出主要二处)
①________________;②________________


(1)写出氨基甲酸铵在密封管内加热至120°C~140°C生成尿素的反应方程式:_______________
(2)仪器B名称________;盛放药品是: ________;
(3)合成氨基甲酸铵的反应在一定条件下能自发进行,该反应的反应热ΔH_____0(填“>” “=”或“<”)
(4)有同学建议该CO2发生装置直接改用“干冰”,你认为他的改进有何优点:(回答二点)
①________________;②________________
(5)该实验装置中有明显导致实验失败的隐患有:(指出主要二处)
①________________;②________________
(1)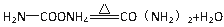
(2)干燥管;碱石灰
(3)<
(4)①装置简单,无需干燥;②低温环境,提高产率
(5)①反应器连接导管过细易造成堵塞②稀硫酸的水蒸气进入反应器使产品不纯③二氧化碳反应器中挥发的氯化氢未经处理进入反应器,会导致实验失败
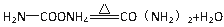
(2)干燥管;碱石灰
(3)<
(4)①装置简单,无需干燥;②低温环境,提高产率
(5)①反应器连接导管过细易造成堵塞②稀硫酸的水蒸气进入反应器使产品不纯③二氧化碳反应器中挥发的氯化氢未经处理进入反应器,会导致实验失败
试题分析:(1)氨基甲酸铵在密封管内加热至120°C~140°C失水生成尿素,反应方程式为
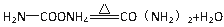
(2)根据仪器的构造可知,仪器B的名称是干燥管;氨基甲酸铵遇水或潮湿空气则生成碳酸铵或碳酸氢铵,所以要求氨气与二氧化碳气体是干燥的,干燥氨气的试剂应是碱石灰;
(3)合成氨基甲酸铵的反应是气体物质的量减小的熵减反应,△S<0,在一定条件下反应能自发进行则有△H-T△S<0,所以该反应的△H<0;
(4)二氧化碳发生装置直接改用干冰的优点:①装置简单,无需干燥;②低温环境,提高产率
(5)该实验装置有明显导致实验失败的隐患有①反应器连接导管过细易造成堵塞;②稀硫酸的水蒸气进入反应器使产品不纯;③二氧化碳反应器中挥发的氯化氢未经处理进入反应器,会生成氯化铵,导致实验失败。

练习册系列答案
相关题目