题目内容
下列图中的实验方案,能达到实验目的的是
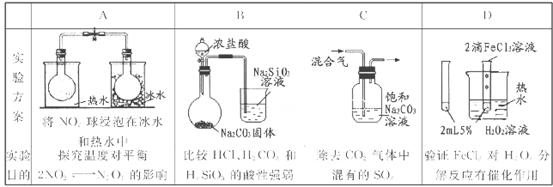

A
试题分析:A.2NO2(g)
 N2O4.(g) ΔH<O. 将两个NO2平衡球分别放在热水、冰水中。平衡球放在热水中颜色加深,放在冰水中颜色变浅。说明升高温度,化学平衡向逆反应方向移动,降低温度,化学平衡向正反应方向移动。可见是温度不同化学反应移动的方向不同。正确。B.在复分解反应中,一般是强酸制取弱酸。发生反应:2HCl+Na2CO3=2NaCl+H2O+CO2↑证明:酸性HCl >H2CO3;H2O+CO2+Na2SiO3= Na2CO3+H2SiO3↓. 证明:酸性H2CO3>H2SiO3。但由于HCl有挥发性,挥发出的HCl也会与Na2SiO3发生反应:2HCl+Na2SiO3="2NaCl+" H2SiO3↓.故不能证明酸性:HCl >H2CO3>H2SiO3。错误。C.CO2、SO2都会与溶液中的Na2CO3反应。因此不能达到除去杂质的目的。错误。要验证FeCl3溶液对H2O2的分解有催化作用,应该是其它外界条件相同,只有一个加催化剂,另一个对比的不加催化剂才可以,不能同时有两个变量。错误。
N2O4.(g) ΔH<O. 将两个NO2平衡球分别放在热水、冰水中。平衡球放在热水中颜色加深,放在冰水中颜色变浅。说明升高温度,化学平衡向逆反应方向移动,降低温度,化学平衡向正反应方向移动。可见是温度不同化学反应移动的方向不同。正确。B.在复分解反应中,一般是强酸制取弱酸。发生反应:2HCl+Na2CO3=2NaCl+H2O+CO2↑证明:酸性HCl >H2CO3;H2O+CO2+Na2SiO3= Na2CO3+H2SiO3↓. 证明:酸性H2CO3>H2SiO3。但由于HCl有挥发性,挥发出的HCl也会与Na2SiO3发生反应:2HCl+Na2SiO3="2NaCl+" H2SiO3↓.故不能证明酸性:HCl >H2CO3>H2SiO3。错误。C.CO2、SO2都会与溶液中的Na2CO3反应。因此不能达到除去杂质的目的。错误。要验证FeCl3溶液对H2O2的分解有催化作用,应该是其它外界条件相同,只有一个加催化剂,另一个对比的不加催化剂才可以,不能同时有两个变量。错误。
练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目




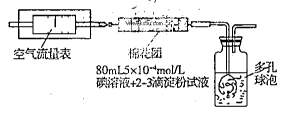
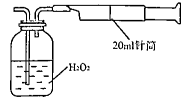 所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。
所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。