题目内容
【题目】研究小组发现一种化合物在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4 min~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是( )
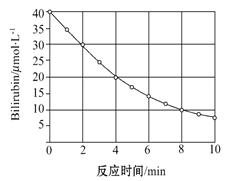
A. 2.5 μmol·L-1·min-1和2.0 μmol·L-1
B. 2.5 μmol·L-1·min-1和2.5 μmol·L-1
C. 3.0 μmol·L-1·min-1和3.0 μmol·L-1
D. 5.0 μmol·L-1·min-1和3.0 μmol·L-1
【答案】B
【解析】试题分析:由图可知,4~8 min期间,反应物浓度变化为(20-10)μ mol/L=10μmol/L,
所以4~8 min期间,反应速率为10μmol/L÷4min=2.5μ mol/(Lmin);
由图可知,0~4 min期间,反应物浓度变化为(40-20)μmol/L=20μmol/L,4~8 min期间,反应物浓度变化为(20-10)μ mol/L=10μmol/L,可知,每隔4分钟,浓度变化量降为原来的一半,所以8~12min浓度变化为5μ mol/L,12~16min浓度变化为2.5μ mol/L,
所以16min时浓度为10μ mol/L-5μ mol/L-2.5μ mol/L=2.5μ mol/L;项B符合题意。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的离子方程式有:;
(2)硫酸铜溶液可以加快氢气生成速率的原因是;
(3)要加快上述实验中气体产生的速率,还可采取的措施有(答两种);
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
实验 | A | B | C | D | E | F |
4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V3= , V8=;
②反应一段时间后,实验A中的金属呈色,实验E中的金属呈色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因 .
④实验A测得:收集到产生H2体积为112mL(标准状况下)时所需的时间为10分钟,求化学反应速率ν(H2SO4)=(忽略反应前后溶液体积变化).


