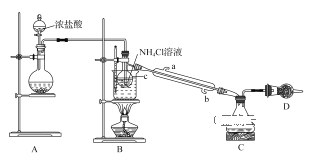
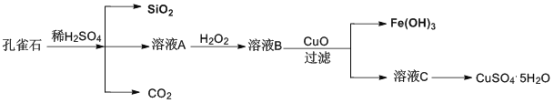题目内容
【题目】Fe2(SO4)3溶液可用于腐蚀绝缘板上的铜箔,制造印刷电路板。现设计了一个方案如下,从腐蚀后的废液(主要含Fe3+、Fe2+、Cu2+)中回收铜,并重新获得Fe2(SO4)3溶液。
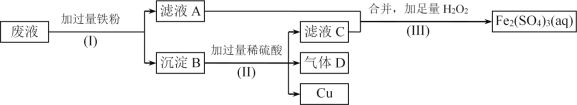
(1)步骤(I)中分离操作名称为____________________。
(2)沉淀B的主要成分有____________________,气体D的电子式为__________。
(3)写出步骤(III)中发生反应的离子方程式______________________________。
【答案】过滤 Cu、Fe H∶H 2Fe2+ +H2O2 + 2H+ = 2Fe3+ +2H2O
【解析】
从腐蚀废液中回收铜,并将铁的化合物全部转化为Fe2(SO4)3溶液,由流程可知,应加入过量的Fe与硫酸铁、硫酸铜反应生成硫酸亚铁、铜,过滤进行分离,则滤液A为FeSO4,沉淀B中含Fe、Cu,加过量硫酸,铁溶解,产生硫酸亚铁和氢气,过滤得到金属Cu,滤液C中含FeSO4、H2SO4,为不引入杂质,将铁的化合物全部转化为Fe2(SO4)3溶液,则通入足量过氧化氢进行氧化,据此解答。
(1)步骤(Ⅰ)中分离溶液和沉淀的操作名称是过滤,
故答案为:过滤;
(2)由流程分析可知,过量的铁将Fe3+还原为Fe2+,Cu2+还原为Cu,则沉淀B中含过量的铁和产生的铜,铁与硫酸反应产生氢气,其电子式为:H:H,
故答案为:Cu、Fe;H:H;
(3)步骤III中过氧化氢将溶液中的Fe2+转化为Fe3+,且不引入新的杂质,发生反应的离子方程式为2Fe2+ +H2O2 + 2H+ = 2Fe3+ +2H2O,
故答案为:2Fe2+ +H2O2 + 2H+ = 2Fe3+ +2H2O。

【题目】下表给出了14种元素的电负性:
元素 | 电负性 | 元素 | 电负性 | 元素 | 电负性 |
Al | 1.5 | B | 2.0 | Be | 1.5 |
C | 2.5 | Cl | 3.0 | F | 4.0 |
Li | 1.0 | Mg | 1.2 | N | 3.0 |
Na | 0.9 | O | 3.5 | P | 2.1 |
Cl | 2.5 | S | 1.8 |
(1)同一周期中,从左到右,主族元素的电负性_________;同一主族中,从上到下,元素的电负性_________。主族元素的电负性随原子序数递增呈_________变化。
(2)短周期元素中,电负性最大的元素与电负性最小的元素形成的化合物属于____________化合物,用电子式表示该化合物:___________________。
(3)已知:两成键元素间的电负性差值大于1.7时,通常形成离子键,两成键元素间的电负性差值小于1.7时,通常形成共价键,则Mg3N2、BeCl2、AlCl3、SiC中为离子化合物的是_________,为共价化合物的是__________________________。