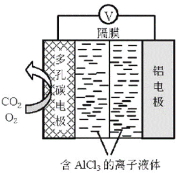
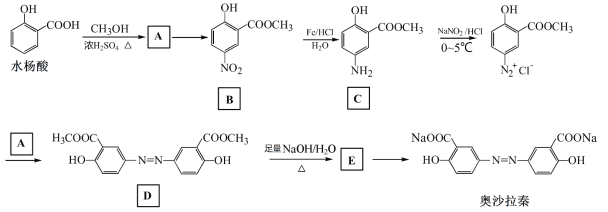
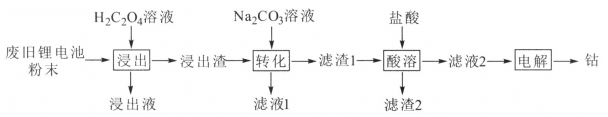
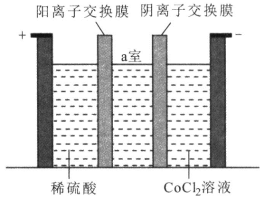
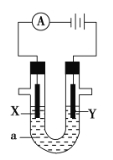
��Ŀ����
����Ŀ��ijʵ��С������ϡ������п����ȡ������ʵ��̽��Ӱ�컯ѧ��Ӧ���ʵ����أ���Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ����ش��������⣺
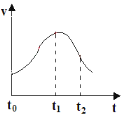
��1��t0~t1�䷴Ӧ���������ԭ����___��
��2������t2ʱ������Һ�м�������CuSO4���壬��Ӧ�������Լӿ죬�Դ˴��չ���о���
��������Ϊ�Ǽ����SO42-���˷�Ӧ�����Ĺ۵�___��������ȷ����������ȷ������������ʵ�����֤����___��
����ͬѧ���ֵ�����϶�CuSO4����ʱ����Ӧ���ʷ����½������ܵ�ԭ����___��
��3����Ҫ�ӿ�t0ʱ��������������ʣ��ӷ�Ӧ��Ƕȿ����ɲ�ȡ�Ĵ�ʩ��___(���ٴ�����)��
���𰸡��÷�Ӧ���ȣ�ʹ�¶����ߣ��Ӷ��ӿ��˷�Ӧ���� ����ȷ ������Һ�м�������Na2SO4���壬�۲췴Ӧ���ʱ仯 п�û����϶�ͭ��������пƬ���棬��ֹ�˷�Ӧ�ķ��� �ʵ��Ӵ�ϡ�����Ũ�ȡ���пƬ����
��������
������������Է�Ӧ���ʵ�Ӱ���Լ���Ӧʵ�ʷ������
��1��Zn��ϡ���ᷴӦ���ȣ����ŷ�Ӧ�IJ��Ͻ��У���Ӧ�ų��������ȣ�ʹ��ϵ�¶����ߣ��¶����ӿ췴Ӧ���ʣ���t0-t1�η�Ӧ��������
��2����t2ʱ�̼�������ͭ����Ӧ���ʼӿ죬��ΪZn������Cu2+�����û���Ӧ����Cu��Cu-Zn-ϡ�������ԭ���װ�ã��ӿ췴Ӧ���ʣ��ʸ�ͬѧ�Ĺ۵��Dz���ȷ�ģ�������������Ӧ�Ľ��У�����ͨ������Һ�м��������ƹ��������֤�������������ƹ����Ӧ���ʼӿ죬��˵�������������ã���֮��û�������ã�
�ڵ������������ͭʱ��Cu2+��Zn��Ӧ���ɴ���Cu������Zn���棬��ֹZn�Ľ�һ����Ӧ��
��3��Ϊ���ӳ�ʼ״̬�µķ�Ӧ���ʣ������ʵ���������Ũ�ȡ���п�������Zn��ϡ����ĽӴ�����ȷ�����

 ��У����ϵ�д�
��У����ϵ�д�