题目内容
下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是
| A.Na2CO3和HCl | B.NaHCO3和Ba(OH)2 | C.NaAlO2和H2SO4 | D.AgNO3和NH3·H2O |
B
解析试题分析:Na2CO3和HCl反应,当前者滴入后者时,后者开始足量,有二氧化碳气体生成,反应方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;当后者滴入前者时,前者开始足量,先无气体,反应方程式为:Na2CO3+HCl=NaHCO3+NaCl。盐酸过量后有二氧化碳气体生成,反应方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑,故A不符合题意;NaHCO3和Ba(OH)2反应,当前者滴入后者时,后者开始足量,反应方程式为:NaHCO3+Ba(OH)2=BaCO3↓+NaOH+H2O;当后者滴入前者时,前者开始足量,反应方程式为:2NaHCO3+Ba(OH)2 =Na2CO3+BaCO3↓+2H2O。无论是前者滴入后者,还是后者滴入前者,现象都是产生白色沉淀,故B正确;NaAlO2和H2SO4反应,当前者滴入后者时,后者开始足量,先有沉淀立刻溶解,先有沉淀反应方程式为:2NaAlO2+H2SO4+2H2O=Na2SO4+2Al(OH)3↓。由于H2SO4过量,生成的Al(OH)3立刻被硫酸中和,反应方程式为:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O。当溶液中铝元素全部变为Al3+时,它与滴入的AlO2-发生双水解反应方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓,现象是最终有沉淀;当后者滴入前者时,前者开始足量,先有沉淀,反应方程式为:2NaAlO2+H2SO4+2H2O=Na2SO4+2Al(OH)3↓。后溶解是由于硫酸过量,反应方程式为:3H2SO4+2Al(OH)3=Al2(SO4)3+6H2O,最终无沉淀,故C不符合题意;氨水与硝酸银溶液中,前者滴入后者发生反应生成沉淀,加入过量的氨水,沉淀溶解,后者滴入前者生成络离子,没有沉淀,则现象不同,故D不符合题意,答案选B。
考点:考查离子反应的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,对学生的要求较高,不易得分。明确反应原理是解答本题的关键,注意互滴顺序不同发生的反应与现象的关系即可解答。有利于激发学生的学习兴趣和学习积极性。

下列各组离子中,在强碱性溶液中一定能共存的是
| A.Na+、NH4+、AlO2ˉ、SO42ˉ |
| B.Na+、Brˉ、SO42ˉ、Clˉ |
| C.K+、Na+、HCO3ˉ、NO3ˉ |
| D.K+、Clˉ、Al3+、CO32ˉ |
在无色的水溶液中能大量共存的一组是( )
| A.Ba2+、AlO2-、OH-、Al3+ |
| B.K+、Fe3+、MnO4-、SCN- |
| C.Mg2+、H+、SO42-、S2O32- |
| D.NH4+、Ca2+、NO3-、Cl- |
常温,相应条件下,下列各组离子一定能大量共存的是
| A.c(Al3+)=0.1mol/L的溶液中:Na+、K+、AlO2-、OH- |
| B.无色溶液中:K+、CH3COO-、HCO3-、MnO4- |
C.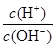 =1×1014的溶液:Ba2+、Na+、SO32-、NO3- =1×1014的溶液:Ba2+、Na+、SO32-、NO3- |
| D.通入足量CO2后所含离子还能大量共存的是:K+、Ca2+、NO3-、Cl- |
下列化学反应的离子方程式正确的是( )
| A.在稀氨水中通入过量CO2:NH3·H2O + CO2 = NH4+ + HCO3- |
| B.少量SO2通入Ca(ClO)2溶液中:SO2 + H2O + Ca2+ +2ClO— = CaSO3↓+2HClO |
| C.用稀盐酸与大理石反应:2H+ + CO32— = H2O + CO2↑ |
| D.氢氧化钡溶液与等物质的量的稀硫酸混合:Ba2+ +OH— +H+ + SO42- = BaSO4↓+H2O |
下列离子方程式表达正确的是
| A.将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- |
| B.向Fe(OH)2中加入足量的稀HNO3:Fe(OH)2+2H+=Fe2++2H2O |
| C.向碳酸氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3·H2O |
| D.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
某同学对一无色透明溶液进行分析得出该溶液中含有下列某组离子,你认为该组离子应该是( )
| A.Al3+、NO3―、K+、SO42ˉ | B.Ca2+、H+、CO32ˉ、AlO2― |
| C.OHˉ、SO42ˉ、NH4+、Al3+ | D.Fe3+、Mg2+、NO3ˉ、Clˉ |
(10分)近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量物质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应的化学方程式为:
C+ K2Cr2O7 + H2SO4(稀) CO2↑+ Cr2 (SO4) 3+ + .
CO2↑+ Cr2 (SO4) 3+ + .
(1)此反应的氧化剂是 ,被氧化的元素是 。
(2)完成并配平上述反应的化学方程式。
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
(5)K2Cr2O7可用于测定亚铁盐的含量,现有FeSO4试样0.4000克,溶解酸化后,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定,消耗标准溶液20.00mL,则该试样中FeSO4的质量分数为 。
(1)某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 | 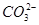 、 、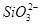 、 、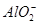 、Cl- 、Cl- |
| 阳离子 | Al3+、Cu2+、Mg2+、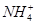 、Na+ 、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y的体积(V)的关系如图所示。
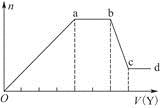
①若Y是盐酸,则溶液中含有的金属阳离子是____________________________,
ab段发生反应的总离子方程式为______________________________________,
表中Oa段与Y溶液反应的离子的物质的量之比为__________[要标明离子符号,如n(Na+)]。
②若Y是NaOH溶液,则bc段反应的离子方程式为
_________________________________________________________________。
若不考虑离子的水解因素,忽略H+和OH-的影响,且溶液中只存在4种离子,则它们的离子个数比为____________________________________________[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列]。
(2)锡为第ⅣA族元素,锡的单质和化合物与某些物质的化学性质上有许多相似之处。已知锡元素具有如下性质:
Sn4++Sn=2Sn2+;
2Sn2++O2+4H+=2Sn4++2H2O;
2H++SnO
 Sn(OH)2
Sn(OH)2 Sn2++2OH-。
Sn2++2OH-。试回答:
①锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的离子方程式:
___________________________________,________________________________。
②将①中溶液蒸干后继续加热所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是(分子式)__________。
③若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2, 该碱是__________。