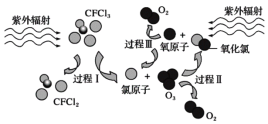
题目内容
【题目】已知:pKa=-lgKa,25 ℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 H2SO3溶液的滴定曲线如图所示。下列说法不正确的是
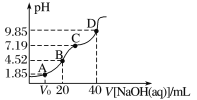
A.C点所得溶液中:c(Na+)>3c(![]() )
)
B.D点所得溶液中水解平衡常数Kh1=10- 6.81
C.A点所得溶液中:V0等于10 mL
D.B点所得溶液中:c(Na+)+c(H+)=2c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
【答案】C
【解析】
滴定过程中依次发生:H2SO3+NaOH=NaHSO3+H2O、NaHSO3+NaOH=Na2SO3+H2O;两种溶液浓度相同,所以当滴加20mLNaOH溶液时溶液中的溶质为NaHSO3,当滴加40mLNaOH溶液时,溶液中的溶质为Na2SO3。
A.C点pH=7.19=pKa2,Ka2=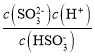 ,所以C点
,所以C点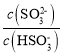 =1,即c(
=1,即c(![]() )=c(
)=c(![]() ),溶液中存在电荷守恒c(Na+)+c(H+)=2c(
),溶液中存在电荷守恒c(Na+)+c(H+)=2c(![]() )+c(
)+c(![]() )+c(OH-),此时溶液显碱性,所以c(H+)< c(OH-),则c(Na+)>2c(
)+c(OH-),此时溶液显碱性,所以c(H+)< c(OH-),则c(Na+)>2c(![]() )+c(
)+c(![]() ),也就是c(Na+)>3c(
),也就是c(Na+)>3c(![]() ),故A正确;
),故A正确;
B.D点所得溶液溶质为Na2SO3,![]() 的水解平衡常数Kh1=
的水解平衡常数Kh1=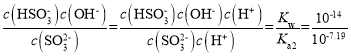 =10- 6.81,故B正确;
=10- 6.81,故B正确;
C.A点pH=1.85= pKa1,Ka1=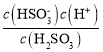 ,所以该点溶液中c(
,所以该点溶液中c(![]() )=c(H2SO3),当加入10mLNaOH溶液时,溶液中的溶质为等物质的量的H2SO3和NaHSO3,NaHSO3为强电解质,而
)=c(H2SO3),当加入10mLNaOH溶液时,溶液中的溶质为等物质的量的H2SO3和NaHSO3,NaHSO3为强电解质,而![]() 的电离程度小于H2SO3,且H2SO3电离产生
的电离程度小于H2SO3,且H2SO3电离产生![]() ,所以此时溶液中c(
,所以此时溶液中c(![]() )>c(H2SO3),故V0不等于10mL,故C错误;
)>c(H2SO3),故V0不等于10mL,故C错误;
D.B点所得溶液中存在电荷守恒:c(Na+)+c(H+)=2c(![]() )+c(
)+c(![]() )+c(OH-),故D正确;
)+c(OH-),故D正确;
故答案为C。