题目内容
【题目】某大型精炼铜厂,在电解铜的阳极泥中含有3-14℅Se元素,(Se和S同主族化学性质相似)以Se单质、Cu2Se存在,还含有稀有金属及贵金属。人体缺乏Se就会得“克山病”,Se也是制光电池的一种原料。从阳极泥中提取Se的流程如下:
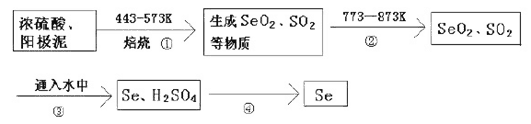
(1)流程②的目的是_________________.流程④操作用到的玻璃仪器有烧杯、______________。
H2SeO3与SO2的离子反应方程式为_____________________________________。
(2)上述工业提取Se的流程中,SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________。工业提取Se的流程中,可循环利用的物质是_________________。
(3)称取5.000g电解铜阳极泥样品以合适方法溶解,配成250.00mL混酸溶液,移取上述溶液25.00mL于锥形瓶中,加入25.00mL0.01000mol·L-1KMnO4标准溶液{只发生Se(+4)转化为Se(+6)}。反应完全后,用0.05000mol·L-1Fe2+标准溶液滴至终点,消耗15.00mL,则电解铜阳极泥中Se的质量分数为____________。若用FeCl2溶液为Fe2+标准溶液滴至终点,对测定Se的质量分数结果是否有影响,理由是_____________。
【答案】使SO2、SeO2挥发出来 漏斗、玻璃棒 H2SeO3+2SO2+H2O=Se+4H++2SO42- H2SO4(浓)>SeO2>SO2 H2SO4 3.95% 有影响,Cl-有还原性在酸性条件下与KMnO4标准溶液反应,使测得Se的质量分数偏低
【解析】
在电解铜的阳极泥中含有 3-14% Se元素,由提纯流程可知,焙烧时S、Se反应转化为SO2、SeO2,二者性质相似,均为分子晶体,加热至773K时为气态,流程②的目的是使SO2、SeO2挥发出来,再加水发生H2SeO3+2SO2+H2O═Se+2SO42-+4H+,Se不溶于水,则流程④为过滤操作,过滤可得到Se,以此来(1)、(2);
(3)由电子守恒可知,Mn的得电子数=Se的失电子数+Fe的失电子数,然后结合Se原子守恒计算Se的质量分数;高锰酸钾可氧化氯离子,干扰Se的含量测定。
在电解铜的阳极泥中含有 3-14% Se元素,由提纯流程可知,焙烧时S、Se反应转化为SO2、SeO2,二者性质相似,均为分子晶体,加热至773K时为气态,流程②的目的是使SO2、SeO2挥发出来,再加水发生H2SeO3+2SO2+H2O═Se+2SO42-+4H+,Se不溶于水,则流程④为过滤操作,过滤可得到Se,
(1)由上述分析可知,流程②的目 的是使SO2、SeO2挥发出来;流程④为过滤操作,需要漏斗、烧杯、玻璃棒;H2SeO3与SO2的离子反应方程式为H2SeO3+2SO2+H2O═Se+2SO42-+4H+,
故答案为:使SO2、SeO2挥发出来;漏斗、玻璃棒;H2SeO3+2SO2+H2O═Se+2SO42-+4H+;
(2)由Se+2H2SO4(浓)![]() SeO2↑+2SO2↑+2H2O、H2SeO3+2SO2+H2O═Se+2SO42-+4H+可知,氧化剂的氧化性大于氧化产物的氧化性,则氧化性为H2SO4(浓)>SeO2>SO2,由反应可知,硫酸在①中消耗,在③中生成,则硫酸可循环利用,
SeO2↑+2SO2↑+2H2O、H2SeO3+2SO2+H2O═Se+2SO42-+4H+可知,氧化剂的氧化性大于氧化产物的氧化性,则氧化性为H2SO4(浓)>SeO2>SO2,由反应可知,硫酸在①中消耗,在③中生成,则硫酸可循环利用,
故答案为:H2SO4(浓)>SeO2>SO2;硫酸;
(3)由电子守恒、原子守恒可知,Se%=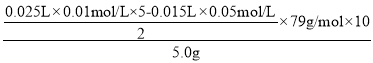 ×100%=3.95%,若FeCl2溶液为 Fe2+标准溶液滴至终点,对测定Se 的质量分数结果是否有影响,因为Cl-有还原性在酸性条件下与KMnO4标准溶液反应,使测得Se 的质量分数偏低,
×100%=3.95%,若FeCl2溶液为 Fe2+标准溶液滴至终点,对测定Se 的质量分数结果是否有影响,因为Cl-有还原性在酸性条件下与KMnO4标准溶液反应,使测得Se 的质量分数偏低,
故答案为:3.95%;有影响,Cl-有还原性在酸性条件下与KMnO4标准溶液反应,使测得Se 的质量分数偏低。