题目内容
【题目】向100mL2mol/L的AlCl3溶液中加入1mol/L的KOH溶液,生成沉淀的质量为7.8g,加入溶液的体积可能为①100mL②300mL③700mL④800mL⑤1000mL()
A.①或②B.②或④C.②或③D.②或⑤
【答案】C
【解析】
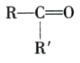
100mL2mol/L的AlCl3溶液中氯化铝的物质的量n=0.1L![]() 2mol/L=0.2mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.2mol
2mol/L=0.2mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.2mol![]() 78g/mol=15.6g>7.8g,说明有两种情况:可能沉淀不完全,只生成Al(OH)3沉淀;也可能沉淀部分溶解,既生成Al(OH)3沉淀又生成NaAlO2,由n(Al(OH)3)=
78g/mol=15.6g>7.8g,说明有两种情况:可能沉淀不完全,只生成Al(OH)3沉淀;也可能沉淀部分溶解,既生成Al(OH)3沉淀又生成NaAlO2,由n(Al(OH)3)=![]() =0.1mol,①若碱不足,由Al3++3OH- =Al(OH)3↓可知NaOH的物质的量为=0.1mol
=0.1mol,①若碱不足,由Al3++3OH- =Al(OH)3↓可知NaOH的物质的量为=0.1mol![]() 3=0.3mol,加入NaOH溶液的体积=
3=0.3mol,加入NaOH溶液的体积=![]() =0.3L=300 mL;
=0.3L=300 mL;
②若沉淀部分溶解,既生成Al(OH)3沉淀又生成NaAlO2,根据Al3++3OH-=Al(OH)3↓可知0.2mol Al3+完全反应消耗0.6mol OH-,生成0.2mol Al(OH)3沉淀,溶解的氢氧化铝为0.2mol-0.1mol=0.1mol,根据Al(OH)3+OH-=AlO2-+2H2O,则消耗的碱的物质的量为0.6mol+0.1mol=0.7mol,加入NaOH溶液的体积=![]() =0.7L=700 mL,所以②或③符合题意;
=0.7L=700 mL,所以②或③符合题意;
所以答案:C。

练习册系列答案
相关题目