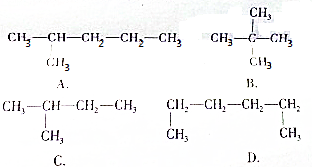题目内容
2.下列说法不正确的是( )| A. | H2O在高温下难分解,而H2S在300℃时就分解,说明O非金属性比S强 | |
| B. | H2CO3的酸性比HClO的酸性强,所以C的非金属性比Cl强 | |
| C. | NaOH的碱性比Mg(OH)2的碱性强,所以Na的金属性比Mg强 | |
| D. | Fe3+的氧化性比Cu2+的氧化性强,但Fe的金属性比Cu强 |
分析 A.非金属的非金属性越强,其氢化物的稳定性越强;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强;
D.元素的金属性越强,其简单最高价阳离子的氧化性越强.
解答 解:A.非金属的非金属性越强,其氢化物的稳定性越强,H2O在高温下难分解,而H2S在300℃时就分解,水比硫化氢难分解,所以说明O非金属性比S强,故A正确;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强,次氯酸不是Cl元素的最高价含氧酸,所以不能据此判断非金属性强弱,故B错误;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强,NaOH的碱性比Mg(OH)2的碱性强,所以Na的金属性比Mg强,故C正确;
D.元素的金属性越强,其简单最高价阳离子的氧化性越强,Fe3+的氧化性比Cu2+的氧化性强,但Fe的金属性比Cu强,故D正确;
故选B.
点评 本题考查金属性和非金属性强弱判断,明确元素周期律内涵是解本题关键,知道金属性、非金属性强弱判断方法,易错选项是B,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.已知甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如图:甲$\stackrel{试剂A}{→}$乙$\stackrel{试剂A}{→}$丙,下列说法不正确的( )
| A. | 若乙为NaHCO3,则丙一定是CO2 | |
| B. | 若A为硝酸,X为金属元素,则甲与丙反应可生成乙 | |
| C. | 若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀 | |
| D. | 若A为金属单质,乙的水溶液遇KSCN溶液变红,则甲可能为非金属单质 |
13.能通过化学反应使溴水褪色,又能使高锰酸钾酸性溶液褪色的是( )
| A. | 乙烷 | B. | 乙醇 | C. | 乙酸 | D. | 二氧化硫 |
10.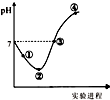 常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
 常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )
常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol•L-1的氢氧化钠溶液,整个过程中pH变化如图所示,下列有关叙述正确的是( )| A. | 曲线起点处水的电离程度最大,可用pH试纸测定溶液pH | |
| B. | ②点之前所发生反应的离子方程式为Cl2+H2O=2H++Cl-+ClO- | |
| C. | 氯气~氯水体系中:c(H+)=c(Cl2)+c(HClO)+c(ClO-) | |
| D. | ③点所示溶液中:c(Na+)=c(Cl-)+c(ClO-) |
17.下列实验方案不能达到实验目的是( )
| 实验目的 | 实验方案 | |
| A | 检验亚硫酸钠固体是否变质 | 取少量固体于试管中,加水溶解,滴加硝酸钡溶液产生白色沉淀,滴加盐酸,观察沉淀是否溶解 |
| B | 测定镁铝混合物中铝的质量分数 | 取mg混合物,加入足量NaOH溶液,充分反应后,过滤、洗涤、烘干,剩余土体ag,计算 |
| C | 检验某无色溶液中说法存在NH4+ | 取少量无色溶液于试管中,滴加NaOH溶液、加热.用湿润的红色石蕊试纸检验生成的气体,观察试纸是否变蓝 |
| D | 除去MgCl2溶液中的少量FeCl3 | 像溶液中加入足量Mg(OH)2分末,充分搅拌、静置、过滤 |
| A. | A | B. | B | C. | C | D. | D |
6.X、Y、Z、W四种元素在元素周期表中的相对位置如图所示,其中X、W的质子数和为21,下列说法正确的是( )
| X | Y | ||
| Z | W |
| A. | X位于元素周期表中第2周期、第ⅤA族 | |
| B. | Y的一种氢化物不稳定,易分解 | |
| C. | W的非金属性比Y的非金属性弱 | |
| D. | Z的最高价氧化物的水化物可与X的最高价氧化物的水化物反应 |
 .
.