题目内容
8.将3.22g氢氧化钠溶解在水中,形成500ml溶液,则该溶液的量浓度是0.161mol/L如果将该溶液稀释到1500ml,则量浓度是0.064mol/L.分析 根据n=$\frac{m}{M}$计算出3.22g氢氧化钠的物质的量,再根据c=$\frac{n}{V}$计算出该氢氧化钠溶液的物质的量浓度;稀释过程中溶质的物质的量不变,据此计算出稀释后溶液的浓度.
解答 解:3.22g氢氧化钠的物质的量为:n(NaOH)=$\frac{3.22g}{40g/mol}$=0.0805mol,则该氢氧化钠溶液的浓度为:c(NaOH)=$\frac{0.0805mol}{0.5L}$=0.161mol./L;
稀释过程中氢氧化钠的物质的量不变,则稀释后溶液中氢氧化钠的浓度为:c(NaOH)=$\frac{0.0805mol}{1.5L}$≈0.064mol/L,
故答案为:0.161mol/L;0.064mol/L.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.

练习册系列答案
相关题目
19.①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.相同条件下,有关上述溶液的比较中正确的是( )
| A. | 水电离的c(H+):①=②=③=④ | |
| B. | 将②、③溶液混合后,pH=7,消耗溶液的体积③>② | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②=④>① | |
| D. | 向各溶液中加入100mL水后,溶液的pH:③>④>①>② |
3.物质的量单位是( )
| A. | mol | B. | g/mol | C. | g | D. | mol/L |
13.下列有关化学用语使用正确的是( )
| A. | 次氯酸的结构式:H-Cl-O | B. | 中子数为1的氢原子:${\;}_{1}^{1}$H | ||
| C. | 甲基的电子式: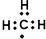 | D. | CO2的比例模型: |
20.关于下列各实验装置图的叙述中,正确的是( )

| A. | 装置①可用于分离碘和氯化钠的固体混合物 | |
| B. | 装置②可用于吸收HCl或NH3气体 | |
| C. | 装置③可用于分解NH4HCO3制备NH3 | |
| D. | 装置④b口进气可收集CO2或NO气体 |
17.某实验小组用0.50mol/LNaOH溶液和0.50mol/L溶液进行中和热的测定.通过测定反应过程中所放出的热量可计算中和反应热.回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒.
(2)大烧杯上如不盖硬纸板,求得的中和反应热数值偏小(填“偏大”、“偏小”、“无影响”).
(3)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应热数值会偏小(填“偏大”、“偏小”或“无影响”);
(4)取50mLNaOH溶液和30mL硫酸进行实验,实验数据如下表.
①请填写下表
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L H2SO4溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-53.5kJ/mol(取小数点后一位).

(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒.
(2)大烧杯上如不盖硬纸板,求得的中和反应热数值偏小(填“偏大”、“偏小”、“无影响”).
(3)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应热数值会偏小(填“偏大”、“偏小”或“无影响”);
(4)取50mLNaOH溶液和30mL硫酸进行实验,实验数据如下表.
实验次数[来源:Zxxk.Com] 温度 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L H2SO4溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-53.5kJ/mol(取小数点后一位).
