题目内容
18.写出以下化学反应的方程式(1)碳酸钠和盐酸Na2CO3+2HCl=2NaCl+H2O+CO2↑
(2)硫酸钠和氯化钡Na2SO4+BaCl2═BaSO4↓+2NaCl
(3)氯化镁和氢氧化钠MgCl2+2NaOH=Mg(OH)2↓+2NaCl
(4)碳酸钾和氯化钙CaCl2+K2CO3═CaCO3↓+2KCl.
分析 (1)碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳;
(2)氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠;
(3)氯化镁与氢氧化钠溶液反应生成氢氧化镁沉淀;
(4)氯化钙和碳酸钾溶液反应生成碳酸钙沉淀和氯化钾.
解答 解:(1)碳酸钠和稀盐酸反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑,
故答案为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(2)氯化钡与硫酸钠溶液反应生成硫酸钡沉淀,反应的方程式为:Na2SO4+BaCl2═BaSO4↓+2NaCl,
故答案为:Na2SO4+BaCl2═BaSO4↓+2NaCl;
(3)氯化镁和氢氧化钠反应,生成氯化钠和氢氧化镁沉淀,反应的方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl,
故答案为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
(4)氯化钙和碳酸钾溶液反应生成碳酸钙沉淀和氯化钾,反应的化学方程式为:CaCl2+K2CO3═CaCO3↓+2KCl,
故答案为:CaCl2+K2CO3═CaCO3↓+2KCl.
点评 本题考查化学反应方程式的书写,书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”,题目难度不大.

练习册系列答案
相关题目
9.下列除杂试剂或操作方法正确的一组是( )
| 序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
| ① | NaCl | BaCl2 | 加入过量的K2CO3溶液,过滤,再加适量的盐酸并加热 |
| ② | FeSO4溶液 | CuSO4 | 加入过量Fe粉,过滤 |
| ③ | H2 | HCl | 通过盛NaHCO3溶液洗气瓶,再通过盛H2SO4洗气瓶 |
| ④ | 自来水 | 植物油 | 蒸馏 |
| A. | ①②③④ | B. | ②③④ | C. | ②④ | D. | ② |
8.下列物质间的转化,能经过一步化合反应直接转化的是( )
| A. | SiO2→H2SiO3 | B. | Na2O2→Na2CO3 | C. | Fe→FeCl2 | D. | Al2O3→Al(OH)3 |
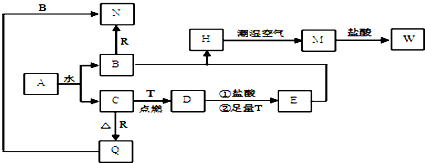

 研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义.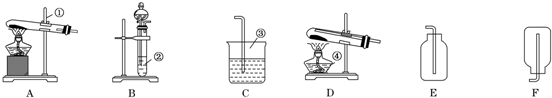
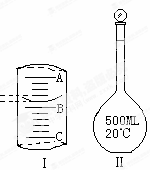 实验室配制500mL0.1mol•Lˉ1Na2CO3溶液,回答下列问题:
实验室配制500mL0.1mol•Lˉ1Na2CO3溶液,回答下列问题: