题目内容
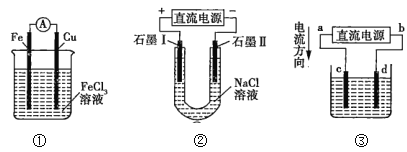
【题目】图中所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑溶液体积的变化,则下列叙述正确的是( )
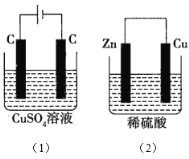
A.产生气体的物质的量:(1)> (2)
B.电极上析出物质的质量:(1)> (2)
C.溶液pH的变化:(1)增大,(2)减小
D.电极反应式:(1)中阳极的电极反应式为4OH--4e-=2H2O+O2↑,(2)中负极的电极反应式为2H++2e-=H2↑
【答案】B
【解析】
根据离子的放电顺序可知,(1)中电解池的总反应方程式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,根据原电池原理,(2)中电池的总反应方程式为Zn+H2SO4=ZnSO4+H2↑。
2Cu+O2↑+2H2SO4,根据原电池原理,(2)中电池的总反应方程式为Zn+H2SO4=ZnSO4+H2↑。
A.线路中转移电子为0.02mol,则(1)、(2)产生气体的物质的量分别为0.005molO2、0.01molH2,(1)<(2),A错误;
B.(1)析出物质为0.01molCu和0.005molO2,(2)析出物质为0.01molH2,则电极上析出物质的质量:(1)> (2),B正确;
C.电池反应发生后,(1)中酸性增强,(2)中酸性减弱,则溶液pH:(1)减小,(2)增大,C错误;
D.电极反应式:(1)中阳极的电极反应式为2H2O-4e-=O2↑+4H+,(2)中负极的电极反应式为Zn-2e-=Zn2+,D错误;
故选B。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】目前世界上60%的镁是从海水中提取的。已知海水提取镁的主要步骤如图:
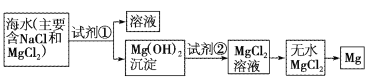
(1)关于加入试剂①作沉淀剂,有以下几种不同方法,请完成下列问题。
方法 | 是否正确 | 简述理由 |
方法1:直接往海水中加入沉淀剂 | 不正确 | 海水中镁离子浓度小,沉淀剂的用量大,不经济 |
方法2:高温加热蒸发海水后,再加入沉淀剂 | 不正确 | (一) |
你认为最合理的其他方法是:(二) | ||
(一)___;
(二)___;
(2)框图中加入的试剂①应该是___(填化学式);加入的试剂②是___(填化学式);工业上由无水MgCl2制取镁的化学方程式为___。
(3)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是___。