题目内容
(13分)氮元素的单质和常见的化合物在工、农业生产中用途广泛。
(1)工业上利用分离空气的方法得到氮气。空气各主要成分的沸点如下:
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是 。
(2)雷雨时空气中的N2转化为NO,生成物NO是 色的气体, (填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应。NO2与水反应的化学方程式为 。
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气。
①制取氨气的化学方程为 ;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为 g。
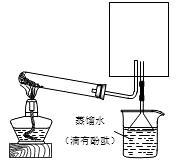
(4)已知:4NH3+6NO 5N2+6 H2O 。化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能。
5N2+6 H2O 。化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能。
 若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。
①NH3与稀硫酸溶液反应的离子方程式为 ;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是 。
(1)工业上利用分离空气的方法得到氮气。空气各主要成分的沸点如下:
| N2 | O2 | Ar | CO2 |
| —196°C | —183°C | —186°C | —78°C |
(2)雷雨时空气中的N2转化为NO,生成物NO是 色的气体, (填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应。NO2与水反应的化学方程式为 。
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气。
①制取氨气的化学方程为 ;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为 g。
(4)已知:4NH3+6NO
 5N2+6 H2O 。化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能。
5N2+6 H2O 。化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能。
|
 若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。
若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。①NH3与稀硫酸溶液反应的离子方程式为 ;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是 。
(1)氮气(1分) (2)无,难,(各1分,共2分)3NO2+H2O=2HNO3+NO(2分)
(3)2NH4Cl+Ca(OH)2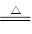 CaCl2+2NH3↑+2H2O (2分) 10.7(2分)
CaCl2+2NH3↑+2H2O (2分) 10.7(2分)
(4)NH3 + H+=NH4+ 溶液显色所需要的时间(各2分,共4分)
(3)2NH4Cl+Ca(OH)2
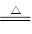 CaCl2+2NH3↑+2H2O (2分) 10.7(2分)
CaCl2+2NH3↑+2H2O (2分) 10.7(2分)(4)NH3 + H+=NH4+ 溶液显色所需要的时间(各2分,共4分)
(1)空气的主要成分是氮气和氧气,氮气的沸点低于氧气的,所以氮气先被分离出来。
(2)NO是无色无味的有毒气体,不溶于水。在空气中极易被氧化生成红棕色的NO2,NO2溶于水又生成NO,同时还有硝酸生成,方程式为3NO+H2O=2HNO3+NO。
(3)实验室制取氨气一般用熟石灰和氯化铵共热生成,方程式为
2NH4Cl+Ca(OH)2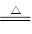 CaCl2+2NH3↑+2H2O。标准状况下4.48L的氨气是
CaCl2+2NH3↑+2H2O。标准状况下4.48L的氨气是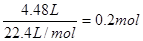 ,所以根据方程式可知需要氯化铵的物质的量也是0.2mol,质量是0.2mol×58.5g/mol=10.7g。
,所以根据方程式可知需要氯化铵的物质的量也是0.2mol,质量是0.2mol×58.5g/mol=10.7g。
(4)氨气属于碱性气体,溶于水显碱性,和硫酸反应生成硫酸铵。离子方程式为NH3 + H+=NH4+。催化剂的催化效果好,则单位时间内产生的氨气就多,和硫酸反应时,溶液颜色变化所需要的时间就长,所以需要测量的数据就是溶液显色所需要的时间
(2)NO是无色无味的有毒气体,不溶于水。在空气中极易被氧化生成红棕色的NO2,NO2溶于水又生成NO,同时还有硝酸生成,方程式为3NO+H2O=2HNO3+NO。
(3)实验室制取氨气一般用熟石灰和氯化铵共热生成,方程式为
2NH4Cl+Ca(OH)2
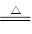 CaCl2+2NH3↑+2H2O。标准状况下4.48L的氨气是
CaCl2+2NH3↑+2H2O。标准状况下4.48L的氨气是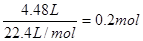 ,所以根据方程式可知需要氯化铵的物质的量也是0.2mol,质量是0.2mol×58.5g/mol=10.7g。
,所以根据方程式可知需要氯化铵的物质的量也是0.2mol,质量是0.2mol×58.5g/mol=10.7g。(4)氨气属于碱性气体,溶于水显碱性,和硫酸反应生成硫酸铵。离子方程式为NH3 + H+=NH4+。催化剂的催化效果好,则单位时间内产生的氨气就多,和硫酸反应时,溶液颜色变化所需要的时间就长,所以需要测量的数据就是溶液显色所需要的时间

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
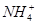 ②H2O ③NH3 ④NH3·H2O ⑤H+ ⑥OH-
②H2O ③NH3 ④NH3·H2O ⑤H+ ⑥OH-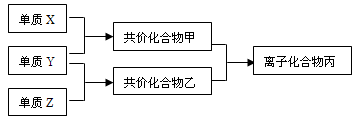
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O