题目内容
16.已知充分燃烧amol乙炔气体时生成1mol CO2气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( )| A. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2b kJ/mol | |
| B. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-4b kJ/mol | |
| C. | C2H2(g)+O2(g)═2CO2(g)+H2O(l)△H=+2b kJ/mol | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-$\frac{b}{a}$kJ/mol |
分析 燃烧amol乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,由物质的物质的量与反应放出的热量成正比可知,生成2mol二氧化碳气体和液态水,并放出热量2bkJ,生成4mol二氧化碳气体和液态水,并放出热量4bkJ,以此来解答
解答 解:燃烧amol乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,由物质的物质的量与反应放出的热量成正比可知,生成2mol二氧化碳气体和液态水,并放出热量2bkJ,生成4mol二氧化碳气体和液态水,并放出热量4bkJ,则乙炔燃烧的热化学方程式为2C2H2(g)+5O2(g)→4CO2(g)+2H2O(l);△H=-4bkJ/mol,
故选:B.
点评 本题考查热化学反应方程式的书写,难度不大,明确物质的量与热量的关系,反应热的符号、数值、单位即可解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.卤代烃的取代反应,实质是带负电荷的原子团取代了卤代烃中的卤原子,例如:CH3Br+OH-(或NaOH)→CH3OH+Br- (或NaBr).下列反应的化学反应方程式中不正确的是( )
| A. | CH3CH2Br+CH3COONa→CH3COOCH2CH3+NaBr | |
| B. | CH3I+CH3ONa→CH3OCH3+NaI | |
| C. | CH3CH2Cl+CH3ONa→CH3Cl+CH3CH2ONa | |
| D. | CH3CH2Cl+CH3CH2ONa→(CH3CH2) 2O+NaCl |
7.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O?3Zn(OH)2+2Fe(OH)3+4KOH.下列叙述不正确的是( )
| A. | 放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5OHFeO${\;}_{4}^{2-}$+4H2O | |
| C. | 放电时每转移3 mol电子,正极有1 mol K2FeO4被还原 | |
| D. | 充电时阴极溶液的碱性减弱 |
11.有关元素周期表的下列说法中,正确的是( )
| A. | 元素周期表有7个主族,8个副族,1个0族 | |
| B. | 同周期元素原子的最外层电子数相同 | |
| C. | 同主族元素从上到下原子半径依次减小 | |
| D. | 金属元素和非金属元素分界线附近的元素可用于制造半导体材料 |
1.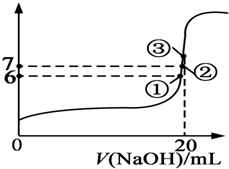 25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线图所示,下列说法正确的是( )
25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线图所示,下列说法正确的是( )
 25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线图所示,下列说法正确的是( )
25℃时,在20mL 0.1mol/L的氢氟酸溶液中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线图所示,下列说法正确的是( )| A. | pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等 | |
| B. | 在①点时pH=6,溶液中:c(F-)-c(Na+)=9.9×10-7mol/L | |
| C. | 在②点时,溶液中:c(F-)<c(Na+) | |
| D. | 在③点时V=20mL,溶液中:c(F-)<c(Na+)=0.1mol/L |
8.下列化学方程式或离子方程式正确的是( )
| A. | 常温下,将铁片置于浓硝酸中:Fe+6HNO3=Fe(NO3)3+3NO2↑+3H2O | |
| B. | AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O | |
| C. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-=BaSO4↓ | |
| D. | 向浓硝酸中加入铜片:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O |
6.下列有关化学用语表示正确的是( )
| A. | 中子数为21的钾原子:${\;}_{19}^{40}$K | |
| B. | 氯化钡的电子式:Ba2+[${\;}_{•}^{•}$$\underset{\stackrel{••}{ci}}{••}$${\;}_{•}^{•}$]${\;}_{2}^{-}$ | |
| C. | N3-的结构示意图: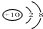 | |
| D. | 聚2-甲基-1,3-丁二烯的结构简式: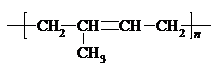 |