题目内容
3.将一定量A、B装入容积为1L的恒温密闭容器中,发生反应:2A(g)+bB(g)?cC(g),1min时达到平衡,C的浓度为x mol•L-1.若保持温度不变,将密闭容器的容积压缩为原来的$\frac{1}{2}$,重新达到平衡后,C的浓度为2.5x mol•L-1,下列说法正确的是( )| A. | 化学计量数的关系:b<c | |
| B. | 容器的容积减小后,该反应的逆反应速率减小 | |
| C. | 原容器中用B浓度变化表示该反应在1 min内的速率为$\frac{cx}{b}$mol•(L•min)-1 | |
| D. | 若保持温度和容器容积不变,充入氦气(不参与反应),平衡不发生移动 |
分析 反应2A(s)+bB(g)?cC(g),1min时达到平衡,C的浓度为x mol•L-1.若保持温度不变,将密闭容器的容积压缩为原来的$\frac{1}{2}$,重新达到平衡后,C的浓度为2.5x mol•L-1,则体积缩小时压强增大,C的浓度大于2xmol/L,即增大压强,化学平衡正向移动,以此来解答.
解答 解:反应2A(s)+bB(g)?cC(g),1min时达到平衡,C的浓度为x mol•L-1.若保持温度不变,将密闭容器的容积压缩为原来的$\frac{1}{2}$,重新达到平衡后,C的浓度为2.5x mol•L-1,则体积缩小时压强增大,C的浓度大于2xmol/L,即增大压强,化学平衡正向移动,
A.增大压强,化学平衡向气体体积缩小的方向移动,所以b>c,故A错误;
B.容器的容积减小后,反应物的浓度增大,压强增大,所以该反应的逆反应速率增大,故B错误;
C.1min时达到平衡,C的浓度为x mol•L-1,v(C)=xmol•L-1•min-1,由反应速率之比等于化学计量数之比可知,v(B)=$\frac{bx}{c}$mol•L-1•min-1,故C错误;
D.若保持温度和容器的容积不变,充入氦气(不参与反应),反应体系中各物质的浓度不变,平衡不移动,故D正确;
故选C.
点评 本题考查化学平衡的计算,明确体积缩小时C的浓度变化来判断平衡移动的方向是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
13.已知反应2A?B+3C,在20℃进行时其v(A)=5mol•L-1•s-1.如果温度每升高10℃,此反应速率增大到原来的2倍.则当其他条件不变时,温度升至50℃时,此反应的化学反应速率v(C)是( )
| A. | 20 mol•L-1•s-1 | B. | 40 mol•L-1•s-1 | C. | 60 mol•L-1•s-1 | D. | 150mol•L-1•s-1 |
14.对下列图象的描述中,正确的是( )
| A. |  根据图可判断正反应的△H<0 | |
| B. |  根据图,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5 | |
| C. |  图可表示压强(p)对反应2A(g)+2B(g)?3C(g)+D(s)的影响 | |
| D. |  图为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
11.对于可逆反应4NH3(g)+5O2(g)═4NO(g)+6H2O(g),下列叙述中正确的是( )
| A. | 达到化学平衡时v正(O2)=v逆(NO) | |
| B. | 若单位时间内生成xmolNO的同时生成 xmolNH3,则反应达到平衡状态 | |
| C. | 达化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若反应发生在体积恒定的密闭容器中,当密度不变时,化学反应达到平衡状态 |
18.下列化合物分子中,在核磁共振氢谱图中能给出三种信号的是( )
| A. | 丙烷 | B. | 丙酮 | C. | 乙醛 | D. | 甲酸乙酯 |
8.十七大把“节能减排”工作放在更加突出的战略位置.下列有关的叙述中,错误的是( )
| A. | 实验室中“通风厨”能排出有害的气体,能防止有害气体污染大气环境 | |
| B. | 减少碳氢化合物、氮氧化物的排放可以有效的防止光化学烟雾的产生 | |
| C. | 处理废弃塑料制品较为合理的方法是用化学方法将废弃塑料加工成防水涂料或汽油 | |
| D. | 对废弃电池进行集中回收后处理的主要目的是防止重金离子的污染 |
15.用水就能鉴别的一组物质是( )
| A. | 乙烯、乙炔 | B. | 乙酸、乙醛 | C. | 苯、甲苯 | D. | 己烷、乙醇 |
12.利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是( )
| A. | 电解时可以精铜为阳极,以CuSO4溶液为电解液 | |
| B. | 电解时阴极发生还原反应 | |
| C. | 粗铜连接电源负极,其电极反应是Cu-2e-=Cu2+ | |
| D. | 电解结束后,电解质溶液的浓度保持不变 |
13.氨在化肥生产、贮氢及燃煤烟气脱硫脱硝等领域用途非常广泛.
(1)尿素[CO(NH2)2]与氰酸铵(NH4CNO)互为同分异构体;氰酸铵属于离子化合物(选填:“离子”或“共价”).
(2)液氨是一种贮氢材料,气态氨转变为液氨将释放能量(选填:“吸收”或“释放”).液氨可通过图1装置释放氢气,该过程中能量转化方式为电能转化为化学能.
(3)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)?5N2(g)+6H2O(g).
①能说明该反应已达到平衡状态的标志是bc(不定项选择).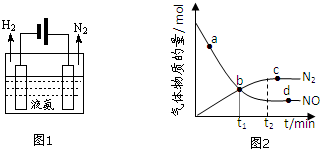
a.反应速率ν( NH3)=ν( N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图2所示,图中ν(正)与ν(逆)相等的点为cd(选填字母).
(4)已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表
则合成氨反应:N2(g)+3H2 (g)═2NH3(g)△H=-90.8kJ•mol-1
(5)工业上用氨水吸收硫酸工业尾气中的SO2,既可消除污染又可获得NH4HSO3等产品.若用1000kg 含NH3质量分数为17%的氨水吸收SO2且全部转化为NH4HSO3,不考虑其它成本,则可获得的利润为782元(参照下面的价格表).
(1)尿素[CO(NH2)2]与氰酸铵(NH4CNO)互为同分异构体;氰酸铵属于离子化合物(选填:“离子”或“共价”).
(2)液氨是一种贮氢材料,气态氨转变为液氨将释放能量(选填:“吸收”或“释放”).液氨可通过图1装置释放氢气,该过程中能量转化方式为电能转化为化学能.
(3)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)?5N2(g)+6H2O(g).
①能说明该反应已达到平衡状态的标志是bc(不定项选择).

a.反应速率ν( NH3)=ν( N2)
b.容器内压强不再随时间而发生变化
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图2所示,图中ν(正)与ν(逆)相等的点为cd(选填字母).
(4)已知:断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表
| 共价键 | H-H | N-H | N≡N |
| 能量变化/kJ•mol-1 | 436 | 390.8 | 946 |
(5)工业上用氨水吸收硫酸工业尾气中的SO2,既可消除污染又可获得NH4HSO3等产品.若用1000kg 含NH3质量分数为17%的氨水吸收SO2且全部转化为NH4HSO3,不考虑其它成本,则可获得的利润为782元(参照下面的价格表).
| NH3质量分数17%的氨水 | 无水NH4HSO3 | |
| 价格(元/kg) | 1.0 | 1.8 |