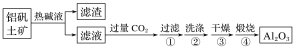
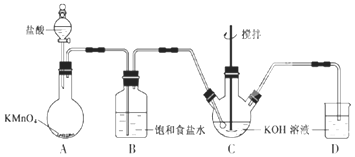
题目内容
【题目】在实验室中模拟工业制取NaHCO3的实验步骤如下:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:分离C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4C1晶体析出。
(1)如图所示装置的连接顺序是:a接__;__接__;b接__(填接口编号)。

(2)A中常选用的固体反应物为___;D中应选用的液体为__。
(3)第二步中必须先让___装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是___;装有无水CaCl2的U形管的作用是__。
(5)第三步分离出NaHCO3固体的操作是__。
(6)第四步中所加固体粉末化学式为___;所得的晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验,证明所得晶体大部分是NH4C1。简要写出操作和现象:__。
【答案】f e d c CaCO3+2H+=Ca2++H2O+CO2↑ 饱和碳酸氢钠溶液 B 防倒吸 吸收多余的NH3 过滤 NaCl 取少量固体放入试管中,加热,固体大部分消失,在试管口内壁又有较多的固体凝结
【解析】
(1)由装置可知:A制取CO2,制备的CO2中混有HCl,用装置D除去二氧化碳中的HCl,装置B制取NH3,二氧化碳与氨气通入C中,其中氨气应防止倒吸,据此分析连接仪器装置;
(2)A装置是制备二氧化碳气体一般用碳酸钙和盐酸反应生成,二氧化碳气体中含有氯化氢气体,会影响碳酸氢钠的生成,D为除杂装置,可以用饱和碳酸氢钠溶液;
(3)氨气易溶于水,二氧化碳在水中的溶解度较小,制取碳酸氢钠时先要得到含氨的饱和食盐水;
(4)C中用球形干燥管球形部分空间大,液面上升缓慢,起缓冲作用,所以不用直导管;装有无水CaCl2的U形管的作用吸收多余的NH3;
(5)分离NaHCO3固体通常用过滤操作;
(6)为了析出氯化铵晶体,则向滤液中加入适量的NaCl粉末,提高氯离子浓度,使NH4Cl晶体析出;实验证明所得固体的成分大部分是氯化铵,是利用氯化铵的性质,受热生成氯化氢和氨气气体,在试管口处温度降低重新生成固体氯化铵分析判断。
(1)A制取CO2,制备的CO2中混有HCl,用装置D除去二氧化碳中的HCl,为除杂充分,导气管应长进短出,故a连接f,装置B制取NH3,二氧化碳与氨气通入C中,氨气极易溶于水,故要注意防止倒吸,则e连接d,b连接c,
故答案为:f;e;d;c;
(2)A装置为固液制备二氧化碳,实验室常用碳酸钙和盐酸反应生成,离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,生成的二氧化碳气体中含有氯化氢,若不除去碳酸氢钠难以形成,所以应用饱和碳酸氢钠溶液除去,
故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;饱和碳酸氢钠溶液;
(3)侯氏制碱法是利用氨气溶解性大极易溶解于水,二氧化碳气体水中溶解性较小,实验时向饱和食盐水中先通入氨气,再通入二氧化碳气体;实验操作过程中,应让B装置先发生反应,
故答案为:B;
(4)氨气极易溶于水,用直导管向饱和氯化钠溶液中通入氨气,容易发生倒吸,C中用球形干燥管球形部分液面上升慢起缓冲作用,可以防止倒吸;装有无水CaCl2的U形管的作用吸收多余的NH3,
故答案为:防倒吸;吸收多余的NH3;
(5)碳酸氢钠在饱和食盐水中溶解度较小,会析出,因此分离NaHCO3固体和液体用过滤的方法,
故答案为:过滤;
(6)第四步中为了析出氯化铵晶体,则向滤液中加入适量的NaCl粉末,提高氯离子浓度,使NH4Cl晶体析出;所得固体的成分大部分是氯化铵,是利用氯化铵的分解产物为气体,温度降低氨气和氯化氢气体会重新生成固体氯化氨,方法为:取少量固体放入试管中,加热,固体大部分消失,在试管口内壁又有较多的固体凝结,从而证明所得固体的成分大部分是氯化铵,
故答案为:NaCl;取少量固体放入试管中,加热,固体大部分消失,在试管口内壁又有较多的固体凝结。

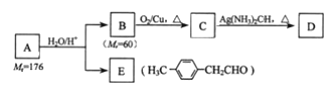
【题目】某废旧电池材料的主要成分为钴酸锂![]() ,还含有一定量的铁、铝、铜等元素的化合物,其回收工艺如图所示,最终可得到
,还含有一定量的铁、铝、铜等元素的化合物,其回收工艺如图所示,最终可得到![]() 和锂盐。
和锂盐。

已知:CoC2O4·2H2O微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的![]() 离子生成
离子生成![]() 而溶解。
而溶解。
(1)“还原酸浸”过程中,![]() 发生反应的离子方程式为:_______________________________________,该过程温度通常控制在
发生反应的离子方程式为:_______________________________________,该过程温度通常控制在![]() 以下的原因是:______________________________________。
以下的原因是:______________________________________。
(2)“除铝铁”过程的两种试剂的作用分别是________________________,____________________________。
(3)“除铜”所用试剂X为![]() ,试写出该反应的离子方程式:_______________________________。
,试写出该反应的离子方程式:_______________________________。
(4)“沉钴”过程中,![]() 的加入量
的加入量![]() 图
图![]() 、沉淀反应的温度
、沉淀反应的温度![]() 图
图![]() 与钴的沉淀率关系如下图所示:
与钴的沉淀率关系如下图所示:
![]() 随
随![]() :
:![]() 比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因_____________________。
比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因_____________________。
![]() 沉淀反应时间为10min,温度在
沉淀反应时间为10min,温度在![]() 以上时,随温度升高而钴的沉淀率下降的可能原因是___________________________________________。
以上时,随温度升高而钴的沉淀率下降的可能原因是___________________________________________。

(5)已知“沉锂”过程中,滤液a中的![]() 约为10-1mol/L,部分锂盐的溶解度数据如下表所示。
约为10-1mol/L,部分锂盐的溶解度数据如下表所示。
温度 | Li2SO4 | Li2CO3 |
0℃ | 36.1g | 1.33g |
100℃ | 24.0g | 0.72g |
结合数据分析,沉锂过程所用的试剂b是__________![]() 写化学式
写化学式![]() ,检验沉淀洗净的方法是___________________________________________________________。
,检验沉淀洗净的方法是___________________________________________________________。
【题目】实验室用图所示装置制备KClO溶液,并通过KClO溶液与![]() 溶液的反应制备高效水处理剂
溶液的反应制备高效水处理剂![]() 已知
已知![]() 具有下列性质
具有下列性质![]() 可溶于水、微溶于浓KOH溶液,
可溶于水、微溶于浓KOH溶液,![]() 在
在![]() 、强碱性溶液中比较稳定,
、强碱性溶液中比较稳定,![]() 在
在![]() 和
和![]() 催化作用下发生分解,
催化作用下发生分解,![]() 在酸性至弱碱性条件下,能与水反应生成
在酸性至弱碱性条件下,能与水反应生成![]() 和
和![]() 。
。
(1)装置A中![]() 与盐酸反应生成
与盐酸反应生成![]() 和
和![]() ,其化学方程式为______,装置B的作用是______。
,其化学方程式为______,装置B的作用是______。
(2)![]() 和KOH在较高温度下反应生成
和KOH在较高温度下反应生成![]() ,试写出该反应的离子方程式______。
,试写出该反应的离子方程式______。
(3)制备![]() 时,KClO饱和溶液与
时,KClO饱和溶液与![]() 饱和溶液的混合方式为:在搅拌下,将
饱和溶液的混合方式为:在搅拌下,将![]() 饱和溶液缓慢滴加到KClO饱和溶液中。理由是______。
饱和溶液缓慢滴加到KClO饱和溶液中。理由是______。
(4)已知![]() 时
时![]() 能溶于NaOH溶液生成
能溶于NaOH溶液生成![]() 下表列出了几种离子生成氢氧化物沉淀的
下表列出了几种离子生成氢氧化物沉淀的![]() 开始沉淀的pH按金属离子浓度为
开始沉淀的pH按金属离子浓度为![]() 计算
计算![]() 。
。
开始沉淀的pH | 沉淀完全的pH | |
|
|
|
|
|
|
|
|
|
实验中可选用的试剂:![]() 、
、![]() 、
、![]() 由某硫酸锌溶液
由某硫酸锌溶液![]() 含
含![]() 、
、![]() 杂质
杂质![]() 制备ZnO的实验步骤依次为:
制备ZnO的实验步骤依次为:
![]() ______;
______;
![]() ______;
______;
![]() 过滤;
过滤;
![]() ______;
______;
![]() 过滤、洗涤、干燥;
过滤、洗涤、干燥;
![]() 煅烧。
煅烧。