题目内容
20.氮元素、氧元素是空气组成的主要元素,可以形成多种化合物.回答以下问题:(1)基态氮原子的价电子排布式是2s22p3,氧元素基态原子核外未成对电子数为2个.
(2)C、N、O三种元素第一电离能从大到小的顺序是N>O>C.
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.NH3分子的空间构型是三角锥形;N2H4分子中氮原子轨道的杂化类型是sp3;肼能与硫酸反应生成N2H6SO4.N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在d(填标号)
a.离子键 b.共价键 c.配位键 d.范德华力
(4)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为O-H键、氢键、范德华力.
(5)H+可与H2O形成H3O+,H3O+中O原子采用sp3杂化.H3O+中H-O-H键角比H2O中H-O-H键角大,原因为H2O中O原子有2对孤对电子,H3O+只有1对孤对电子,排斥力较小.
(6)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为ag/cm3.NA表示阿伏加德罗常数,则CaO晶胞体积为$\frac{224}{{a{N_A}}}$cm3.
分析 (1)N原子最外层电子数是5个电子,2个电子位于2s能级、3个电子位于2p能级;O元素基态原子核外有两个未成对电子;
(2)同一周期元素,元素第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(3)氨气分子中N原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论判断空间构型;肼分子中每个N原子价层电子对个数是4,根据价层电子对互斥理论判断N原子杂化方式;
N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内离子键、配位键和共价键;
(4)氢键键能介于化学键和分子间作用力之间;
(5)水合氢离子中O原子价层电子对个数是4,根据价层电子对互斥理论判断O原子杂化类型;孤电子对间的排斥力大于孤电子对和共用电子对之间的排斥力;
(6)CaO是面心立方晶胞,其结构和NaCl相似,则该晶胞中钙离子、氧离子个数都是4,晶胞体积=$\frac{\frac{M}{{N}_{A}}×4}{ρ}$.
解答 解:(1)N原子最外层电子数是5个电子,2个电子位于2s能级、3个电子位于2p能级,所以其价电子排布式为2s22p3;O元素基态原子核外有两个未成对电子,
故答案为:2s22p3;2;
(2)同一周期元素,元素第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,N元素位于第VA族,所以这三种元素第一电离能大小顺序是N>O>C,故答案为:N>O>C;
(3)氨气分子中N原子价层电子对个数是4且含有一个孤电子对,根据价层电子对互斥理论知空间构型为三角锥形;肼分子中每个N原子价层电子对个数是4,根据价层电子对互斥理论知N原子杂化方式为sp3,
N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内离子键、配位键和共价键,不存在范德华力,
故答案为:三角锥形;sp3;d;
(4)氢键键能介于化学键和分子间作用力之间,化学键键能最大,所以H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为O-H键、氢键、范德华力,
故答案为:O-H键、氢键、范德华力;
(5)水合氢离子中O原子价层电子对个数是4,根据价层电子对互斥理论知O原子杂化类型为sp3;孤电子对间的排斥力大于孤电子对和共用电子对之间的排斥力,H2O中O原子有2对孤对电子,H3O+只有1对孤对电子,排斥力较小,所以H3O+中H-O-H键角比H2O中H-O-H键角大,
故答案为:sp3;H2O中O原子有2对孤对电子,H3O+只有1对孤对电子,排斥力较小;
(6)CaO是面心立方晶胞,其结构和NaCl相似,则该晶胞中钙离子、氧离子个数都是4,晶胞体积=$\frac{\frac{M}{{N}_{A}}×4}{ρ}$=$\frac{\frac{56}{{N}_{A}}×4}{a}$cm3=$\frac{224}{{a{N_A}}}$cm3,
故答案为:$\frac{224}{{a{N_A}}}$.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、原子杂化方式判断、微粒空间构型判断、氢键等知识点,利用价层电子对互斥理论、构造原理等知识解答即可,难点是晶胞计算,注意氢键不是化学键,为分子间作用力.

| A. | 分子中三个碳原子可能处于同一直线上 | |
| B. | 全氟丙烷的电子式为: | |
| C. | 相同压强下,沸点:C3F8<C3H8 | |
| D. | 全氟丙烷分子中既有极性键又有非极性键 |
| A. | 断裂化学键 | B. | 形成化学键 | C. | 化合反应 | D. | 分解反应 |
| A. | H2、D2和T2互称为同素异形体 | B. | 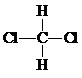 和 和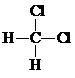 互称为同分异构体 互称为同分异构体 | ||
| C. | 35Cl和37Cl 互称为同位素 | D. | C2H4与C4H8一定能互称为同系物 |
| A. | Y在化合物中显+3价 | |
| B. | X与W只能形成一种化合物 | |
| C. | W的简单氢化物稳定性比Z的强 | |
| D. | X的最高价氧化物对应的水化物碱性比Y的强 |
①
 △H=-116kJ•mol-1
△H=-116kJ•mol-1②
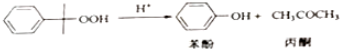 △H=-253k•mol-1
△H=-253k•mol-1
相关化合物的物理常数:
| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 异丙苯 | 120 | 0.8640 | 153 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 苯酚 | 94 | 1.0722 | 182 |
(2)反应①和②分别在装置A和C中进行(填装置符号).
(3)在分解釜C中加入的Y为少量浓硫酸,其作用是催化剂,优点是用量少,缺点是腐蚀设备.
(4)反应②为放热(填“放热”或“吸热”)反应.反应温度控制在50-60℃,温度过高的安全隐患是温度过高会导致爆炸.
(5)中和釜D中加入的Z最适宜的是c(填编号)
a.NaOH b.CaCO3 c.NaHCO3 d.CaO
(6)蒸馏塔F中的馏出物T和P分别为丙酮和苯酚,判断的依据是丙酮的沸点低于苯酚.
(7)用该方法合成苯酚和丙酮的优点是原子利用率高.


 );下列试剂能与甲反应而褪色的是AC(填标号)
);下列试剂能与甲反应而褪色的是AC(填标号)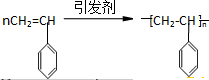 .
.