题目内容
11.下列过程或变化一定吸收能量的是( )| A. | 断裂化学键 | B. | 形成化学键 | C. | 化合反应 | D. | 分解反应 |
分析 化学键断裂吸热,化学键形成放热;
常见的放热反应有:所有的物质燃烧、所有金属与酸或与水、所有中和反应、绝大多数化合反应、铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气等)还原金属氧化物、某些复分解(如铵盐和强碱).
解答 解:A.断裂化学键吸收能量,故A正确;
B.原子形成化学键放出能量,故B错误;
C.化合反应是放热反应,故C错误;
D.有些分解反应是放热的,如双氧水的分解,故D错误.
故选A.
点评 本题考查了化学反应的本质,注意化学键断裂吸热,化学键形成放热,掌握常见的放热反应和吸热反应是解题的关键,题目较简单.

练习册系列答案
相关题目
1.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,22.4 L乙烯中含C-H键的数目为4NA | |
| B. | 1molFe与足量盐酸反应转移电子数为3NA | |
| C. | 1.6g由氧气和臭氧组成的混合物中含有的氧原子数目为0.1NA | |
| D. | 向1L 1 mol•L-1氯化铝溶液中加入足量的氨水,生成AlO2-的个数为NA |
2.下列有关溶液的说法中,正确的是( )
| A. | 物质的量浓度相等的NH4Al(SO4)2、NH4HCO3、NH4Cl溶液中c(NH4+):NH4HCO3>NH4Cl>NH4Al(SO4)2 | |
| B. | 1.0mol/L Na2CO3溶液:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) | |
| C. | 测得酸式盐NaHA溶液的pH=3,则NaHA在溶液中一定是电离大于水解 | |
| D. | 常温下0.4mol/L HB溶液与0.2mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(Na+)>c (B-)>c (H+)>c(OH-) |
19.氯化钠溶液中溶解了部分单质碘,将其进行分离的正确方法是( )
| A. | 分液 | B. | 萃取 | C. | 蒸馏 | D. | 过滤 |
16.环境问题是全球共同关注的问题,环境污染的发生、危害与防治都与化学有关.根据有关的化学知识,下列说法正确的是( )
| A. | 严禁排放未经处理的有毒工业废水--防止水土流失 | |
| B. | 不允许焚烧农作物秸秆--防止温室效应 | |
| C. | 限制生产含磷洗涤剂--防止江河、湖泊出现“赤潮” | |
| D. | 限制生产不符合尾气排放标准的汽车--防止氮的氧化物及一氧化碳等污染空气 |
3.某溶液中含有大量的下列离子:Fe3+、SO42-、Al3+和M离子,经测定Fe3+、SO42-、Al3+和M离子的物质的量之比为2:4:1:1,则M离子可能是下列中的( )
| A. | Na+ | B. | NO3- | C. | Mg2+ | D. | OH- |
8.短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
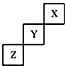

| A. | Y的单质的熔点比Z的低 | |
| B. | Y的最高正化合价为+5 | |
| C. | Z的氢化物的稳定性比Y的强 | |
| D. | X、Y、Z三种元素中,单质在常温下均为气态 |
 已知A、B、C、D、E、F六种元素的原子序数依次递增,都位于前四周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.F处于周期表中第9列.
已知A、B、C、D、E、F六种元素的原子序数依次递增,都位于前四周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.F处于周期表中第9列.