题目内容
5.翡翠是由X、Y、Z、W四种短周期元素组成的矿物,可表示为XY[Z2W6],X、Y、W元素的简单离子的电子层结构相同,X的原子半径比Y的大,Z的单质是常见的半导体材料,W是地壳中含量最多的元素.下列说法不正确的是( )| A. | Y在化合物中显+3价 | |
| B. | X与W只能形成一种化合物 | |
| C. | W的简单氢化物稳定性比Z的强 | |
| D. | X的最高价氧化物对应的水化物碱性比Y的强 |
分析 翡翠是由X、Y、Z、W四种短周期元素组成的矿物,可表示为XY[Z2W6],其中W是地壳中含量最多的元素,则W为O元素;Z的单质是常见的半导体材料,则Z为Si;翡翠属于硅酸盐,X、Y化合价之和为+4,X、Y、W元素的简单离子的电子层结构相同,离子核外电子数为10,且X的原子半径比Y的大,则X为Na、Y为Al,据此解答.
解答 解:翡翠是由X、Y、Z、W四种短周期元素组成的矿物,可表示为XY[Z2W6],其中W是地壳中含量最多的元素,则W为O元素;Z的单质是常见的半导体材料,则Z为Si;翡翠属于硅酸盐,X、Y化合价之和为+4,X、Y、W元素的简单离子的电子层结构相同,离子核外电子数为10,且X的原子半径比Y的大,则X为Na、Y为Al.
A.Y为Al,在化合物中显+3价,故A正确;
B.X为Na、W为O,二者可以形成氧化钠、过氧化钠,故B错误;
C.非金属性O>Si,氢化物稳定性与元素非金属性一致,故氧元素氢化物更稳定,故C正确;
D.金属性Na>Al,金属性越强,最高价氧化物对应水化物的碱性越强,故D正确,
故选B.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重考查学生分析推理能力以及元素周期律,注意对基础知识的掌握.

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
16.环境问题是全球共同关注的问题,环境污染的发生、危害与防治都与化学有关.根据有关的化学知识,下列说法正确的是( )
| A. | 严禁排放未经处理的有毒工业废水--防止水土流失 | |
| B. | 不允许焚烧农作物秸秆--防止温室效应 | |
| C. | 限制生产含磷洗涤剂--防止江河、湖泊出现“赤潮” | |
| D. | 限制生产不符合尾气排放标准的汽车--防止氮的氧化物及一氧化碳等污染空气 |
13.X、Y均为短周期元素,其简单离子aXn-和bYm+电子层结构相同,则下列说法正确的是( )
| A. | b-a=m+n | B. | X的原子半径大于Y | ||
| C. | X的族序数一定小于Y | D. | X不可能是氢元素 |
10.下列化学用语正确的是( )
| A. | 2-乙基-1,3-丁二烯分子的键线式: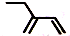 | B. | 丙烷分子的比例模型: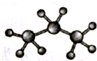 | ||
| C. | 四氯化碳分子的电子式: | D. | 聚丙烯的结构简式: |
4.下列说法错误的是( )
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 乙醇、乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高 | |
| C. | 乙醇和乙酸都能酸性高锰酸钾溶液褪色 | |
| D. | 乙醇和乙酸之间能发生酯化反应,酯化反应为可逆反应 |
1.从海水中提取镁,可按照如下步骤进行:
①把贝壳制成石灰乳;②在引入的海水中加入石灰乳、沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶、过滤、干燥产物;④将所得产物熔融后电解.关于提取镁,
下列说法不正确的是( )
①把贝壳制成石灰乳;②在引入的海水中加入石灰乳、沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶、过滤、干燥产物;④将所得产物熔融后电解.关于提取镁,
下列说法不正确的是( )
| A. | 此法的优点之一是原料丰富 | |
| B. | 进行①②③步操作的目的是从海水中富集氯化镁 | |
| C. | 第④步电解时会产生氯气 | |
| D. | 以上过程中涉及的反应有分解反应、化合反应、复分解反应和置换反应 |
