题目内容
14.Ⅰ、镍(Ni)是一种重要的金属,金属镍及其化合物在合金材料以及催化剂等方面应用广泛.(1)基态Ni原子的价电子(外围电子)排布式为3d84s2;
(2)很多不饱和有机物在Ni催化下可与H2发生加成反应.
如①CH2=CH2、②HC≡CH、③
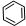 、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形;
、④HCHO,其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形;(3)Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO>FeO(填“<”或“>”);
(4)镍常见化合价为+2、+3,在水溶液中通常只以+2 价离子的形式存在.+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应.NiO(OH)溶于浓盐酸的化学方程式为2NiO(OH)+6HCl(浓)=2NiCl2+Cl2↑+4H2O.
Ⅱ、已知晶体CaF2结构如图Ⅰ所示,图Ⅱ为H3BO3(硼酸)晶体结构图(层状结构,层内的H3BO3分子通过氢键结合),金属铜形成晶体的结构如Ⅲ所示.
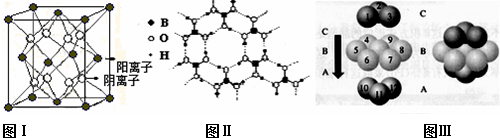
(5)图Ⅲ中铜原子形成的晶体中铜原子的配位数为12.
(6)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是O,H3BO3晶体受热熔化时,克服的微粒之间的相互作用为范德华力和氢键.
(7)图Ⅰ中CaF2晶体的密度为a g•cm-3,则晶胞的体积是$\frac{312}{a{N}_{A}}$cm3(只要求列出计算式,阿伏加德罗常数用NA表示).
分析 Ⅰ、(1)Ni的原子序数为28,根据能量最低原理先写出基态原子核外电子排布式,再写出价电子排布式;
(2)根据碳原子含有的σ键和孤电子对判断碳原子采取的杂化方式; 根据价层电子对互斥理论判断甲醛的空间构型;
(3)根据影响离子晶体熔点的因素有离子半径和电荷判断离子晶体的熔点高低;
(4)NiO(OH)具有氧化性,与盐酸发生氧化还原反应;
Ⅱ、(5)金属铜采用面心立方最密堆积,其配位数=3×8×$\frac{1}{2}$;
(6)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是O原子,H3BO3晶体受热熔化时,克服的微粒之间的相互作用为范德华力和氢键;
(7)根据体积的计算公式V=$\frac{m}{ρ}$进行计算.
解答 解:(1)Ni的原子序数为28,电子排布式为1s22s22p63s23p63d84s2,则价电子排布式是3d84s2,
故答案为:3d84s2;
(2)①CH2=CH2中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
②HC≡CH中每个碳原子含有2个σ键,不含孤电子对,所以采取sp杂化,故错误;
③ 中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
④HCHO中碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
HCHO中碳原子含有3个σ键,不含孤电子对,所以其空间构型是平面三角形;
故答案为:①③④; 平面三角;
(3)影响离子晶体熔点的因素有离子半径和电荷,相同电荷时,离子半径越小,熔点越高,镍离子半径小于亚铁离子半径,所以氧化镍熔点高于氧化亚铁熔点,
故答案为:>;
(4)NiO(OH)具有氧化性,与盐酸发生氧化还原反应,化学方程式为2NiO(OH)+6HCl(浓)=2NiCl2+Cl2↑+4H2O,
故答案为:2NiO(OH)+6HCl(浓)=2NiCl2+Cl2↑+4H2O;
Ⅱ、(5)金属铜采用面心立方最密堆积,其配位数=3×8×$\frac{1}{2}$=12,故答案为:12;
(6)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是O原子,H3BO3晶体为分子晶体,受热熔化时,克服的微粒之间的相互作用为范德华力和氢键;
故答案为:O;范德华力和氢键;
(7)该晶胞中F离子个数=8,钙离子个数=6×$\frac{1}{2}$+8×$\frac{1}{8}$=4,则V=$\frac{m}{ρ}$=$\frac{\frac{40×4+19×8}{{N}_{A}}}{a}$cm3=$\frac{312}{a{N}_{A}}$cm3,
故答案为:$\frac{312}{a{N}_{A}}$.
点评 本题考查了物质结构中电子排布式、杂化类型、晶胞的计算,晶胞的计算利用均摊法解答,要熟练掌握,题目难度中等.

 阅读快车系列答案
阅读快车系列答案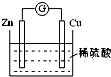
| A. | Zn片是正极 | B. | H+在铜片上得电子 | ||
| C. | 反应过程中电能转变为化学能 | D. | 电子从锌片通过硫酸溶液流向铜片 |
| A. | 48克O2和O3的混合物含有氧原子数3NA | |
| B. | 22.4L甲烷(CH4)所含的原子数为5NA | |
| C. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA | |
| D. | 在20℃,1.01×105Pa(即在标准状况)时,11.2L氧气所含的原子数为NA |
| A. | 一定条件下,0.1molSO2与足量氧气反应生成SO3,转移电子数为0.2NA | |
| B. | 标准状况下,20gD2O分子中所含中子数为10NA | |
| C. | 标准状况下,22.4LCl2完全溶于水时形成氯水时,转移电子数为NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA |
| A. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| B. | 过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 向氯化铝溶液中滴加过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | B. | BaCl2+Na2SO4═2NaCl+BaSO4↓ | ||
| C. | 2NaOH+CO2═Na2CO3+H2O | D. | Zn+CuSO4═ZnSO4+Cu |
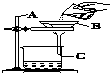 如图所示是某学生设计的过滤操作装置图.
如图所示是某学生设计的过滤操作装置图.