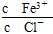题目内容
向10 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.1 mol·L-1的CH3COOH溶液,其pH逐渐减小,图中a,b,c三点的pH为实验中所测得,下列有关说法中一定正确的是 ( )
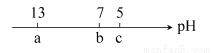
A.当7<pH<13时,溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.当pH=7时,所加CH3COOH溶液的体积为10 mL
C.当5<pH<7时,溶液中c(CH3COO-)>c(Na+)
D.继续滴加0.1 mol·L-1的CH3COOH溶液,溶液的pH最终可以变化至1
C
【解析】最初向NaOH溶液中滴加极少量的CH3COOH溶液时,可能有c(OH-)>c(CH3COO-),故A项错误;当滴加10 mL CH3COOH溶液时,与NaOH溶液恰好完全反应,此时pH>7,B项错误;无限滴加CH3COOH溶液,相当于在0.1 mol·L-1的CH3COOH溶液中滴加少量NaOH溶液,pH一定大于1,D项错误。

弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HNO2 | 4.6×10-4 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3·H2O | 1.8×10-5 |
表2
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10-10 |
BaCO3 | 2.6×10-9 |
CaSO4 | 7×10-5 |
CaCO3 | 5×10-9 |
请回答下面问题:
(1)表1所给的四种酸中,酸性最弱的是________________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是________(填序号)。
A.升高温度
B.加水稀释
C.加少量的CH3COONa固体
D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________(选填“酸性”、“中性”或“碱性”),理由是_______________,溶液中各离子浓度大小关系是______。
(3)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的排列为______________________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量的BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42—物质的量浓度不小于0.01 mol·L-1,则溶液中CO32—物质的量浓度应≥________ mol·L-1。
为了进一步研究硫酸铜的量对氢气生成速率的影响,某同学设计了如表一系列实验。将表中所给的试剂按一定体积混合后,分别加入四个盛有过量Zn粒的反应瓶(甲、乙、丙、丁)中,收集产生的气体,记录收集相同体积的气体所需时间。
实验 试剂/mL | 甲 | 乙 | 丙 | 丁 |
4 mol/L H2SO4 | 20 | V1 | V2 | V3 |
饱和CuSO4溶液 | 0 | 2.5 | V4 | 10 |
H2O | V5 | V6 | 8 | 0 |
下列说法正确的是( )
A.实验甲产生气泡的速率最快 B.V1<V2<V3<20
C.V4=V5=10 D.V6=7.5