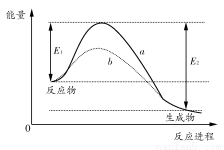
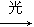题目内容
500℃时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,分析图像完成下列问题:
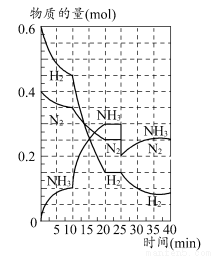
(1)0~10分钟,N2的平均反应速率为________mol·L-1·min-1,0~10分钟与10~20分钟两个时间段中,N2的反应速率之比为________。反应在第10 min可能改变的条件是________,运用图像信息说明该条件不是升温的原因:________。
(2)计算500℃时,反应N2+3H2 2NH3的平衡常数K的数值为________。保持温度不变,反应进行至25 min时,抽去0.1 mol氨,此时平衡常数K将________(填“增大”“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态________(填“大”“小”或“不变”)。
2NH3的平衡常数K的数值为________。保持温度不变,反应进行至25 min时,抽去0.1 mol氨,此时平衡常数K将________(填“增大”“减小”或“不变”)。保持体积不变,达到新平衡后的正反应的化学反应速率比原平衡状态________(填“大”“小”或“不变”)。
(3)在上图中画出25~40 min时间段内N2的物质的量的变化图像。
(1)0.0025;1:2;加入催化剂;三种气体物质的速率增加倍数相同 (2)426.7;不变;小 (3)如图所示。
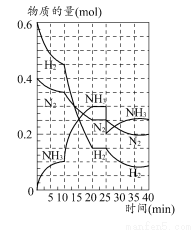
【解析】(1)由图像和速率的计算公式可求知0~10 min,v(N2)=0.05 mol/(2 L×10 min)=0.0025 mol·L-1·min-1;10~20 min,v(N2)=0.1 mol/(2 L×10 min)=0.005 mol·L-1·min-1,所以0~10 min与10~20 min的v(N2)之比为1:2;根据计算10~20 min的v(N2),v(H2),v(NH3)知,三者均增大为原来的2倍,故在10 min时应该是加入了催化剂,而不是升温。(2)500°C时,根据平衡常数K的计算公式即可求得平衡常数K的数值,K=c2(NH3)/c(N2)c3(H2)=0.152/(0.125×0.0753)≈426.7,K只受温度影响,所以减少NH3的量K值不变,但NH3减少后,由于体积不变,浓度减小,故反应速率减小。

室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合后的体积变化)( )
序号 | ① | ② | ③ | ④ |
pH | 12 | 12 | 2 | 2 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.在①、②中分别加入氯化铵晶体,两溶液的pH均增大
B.分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C.把①、④两溶液等体积混合后所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.将溶液②和溶液③等体积混合,混合后所得溶液pH=7