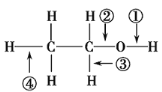
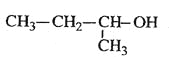题目内容
【题目】(1)硫酸镍溶于过量的氨水可形成[Ni(NH3)6]SO4溶液。
①[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为_____,中心原子(离子)是____;
②SO42-中,中心原子的轨道杂化类型为_______;
③写出一种与SO42-互为等电子体的分子的化学式______;
(2)NH3极易溶于水,除因为它们都是极性分子外,还因为__________。
(3)已知H—H键能为436kJ/mol,N≡N键的键能为945kJ/mol,根据化学方程式:N2+3H2 ==2NH3 ΔH=-92.4kJ/mol,则H—N键能为____kJ/mol。
(4)下列分子既存在p-sp σ键,也存在p-p π键的是_____。
A.NH3 B.H2 C.CO2 D.C2H2
(5)根据已经掌握的共价键知识判断,键的极性N—H___O—H(“>”,“=”或“<”)
【答案】配位键 Ni2+ sp3 CCl4或SiCl4或SiF4 氨分子与水分子之间易形成氢键,氨与水也会发生反应 390.9或391 C <
【解析】
(1)①含有孤电子对和含有空轨道的原子之间可以形成配位键;②SO42-中,S原子的价电子对数=![]() ;③等电子体是原子数相同、价电子数也相同的分子或离子;
;③等电子体是原子数相同、价电子数也相同的分子或离子;
(2)含有H-F、O-H、N-H键的物质易形成氢键;
(3)反应物总键能-生成物总键能=焓变;
(4)σ键是原子轨道“头碰头”形成的共价键 ,π键是原子轨道“肩并肩”形成共价键;
(5)O的电负性大于N;
(1)①[Ni(NH3)6]SO4中Ni2+含有空轨道,NH3中N原子含有孤电子对,Ni2+与NH3之间形成的化学键称为配位键;中心离子是Ni2+;
②SO42-中,S原子的价电子对数=![]() ,S原子的轨道杂化类型为sp3;
,S原子的轨道杂化类型为sp3;
③等电子体是原子数相同、价电子数也相同的分子或离子,SO42-、CCl4、SiCl4、SiF4价电子数都是32,所以与SO42-互为等电子体的分子的化学式是CCl4、SiCl4或SiF4;
(2)NH3与H2O分子间易形成氢键,所以NH3极易溶于水;
(3)设H—N键能为x kJ/mol,则945+436×3-6x=-92.4,x=390.9;
(4)A.NH3 中N-H是s-sp σ键;B.H2中H-H是s-s σ键; C.CO2 中C=O是1个p-spσ键、1个p-pπ键;D.C2H2有s-spσ键、sp-spσ键、p-pπ键,故选C
(5)O的电负性大于N,所以键的极性N—H<O--H;