题目内容
【题目】现有一定温度下的密闭容器中存在如下反应:CO(g)+H2O(g)CO2(g)+H2(g)知CO和H2O的起始浓度均为2mol/L经测定该反应在该温度下的平衡常数K=1,试判断:
(1)当CO转化率为25%时,该反应(填是或否)达到平衡状态,若未达到,向方向移动.
(2)达平衡状态时,CO的转化率为 .
【答案】
(1)否;正
(2)50%
【解析】解:(1)设H2O(g)消耗了xmol/L时,
CO(g)+ | H2O(g) | CO2(g)+ | H2(g) | ||
初始浓度: | 2 | 2 | 0 | 0 | |
变化浓度: | x | x | x | x | |
末态浓度: | 2﹣x | 2﹣x | x | x |
此时K= ![]() =1,解得x=1,
=1,解得x=1,
二氧化碳转化率= ![]() ×100%=50%,当CO转化率为25%时反应未达到平衡状态,CO转化率达到平衡状态需要增大,则反应正向进行,
×100%=50%,当CO转化率为25%时反应未达到平衡状态,CO转化率达到平衡状态需要增大,则反应正向进行,
所以答案是:否; 正;(2)根据以上分析得,CO的转化率为 ![]() ×100%=50%.
×100%=50%.
所以答案是:CO的转化率是50%.
【考点精析】关于本题考查的化学平衡的计算,需要了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】(多选)等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生气体体积V的数据,根据数据绘制得到如图,则曲线a、b、c、d所对应的实验组别可能是( )
组别 | c(HCl)(mol/L) | 温度(℃) | 状态 |
1 | 2.0 | 25 | 块状 |
2 | 2.5 | 30 | 块状 |
3 | 2.5 | 50 | 块状 |
4 | 2.5 | 30 | 粉末状 |
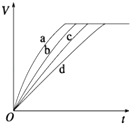
A.4﹣3﹣2﹣1
B.1﹣2﹣3﹣4
C.3﹣4﹣2﹣1
D.1﹣2﹣4﹣3