题目内容
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程,下列叙述中不正确的是( )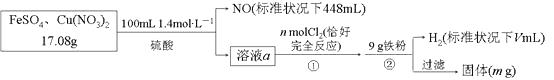
A.n=0.02
B.V=2240
C.m=3.2
D.元混合物中FeSO4的质量分数约为89%
【答案】C
【解析】解:步骤②中加入铁粉后有H2生成,说明前面所加硫酸过量,溶液a能与Cl2反应,说明含有Fe2+ , 即加稀硫酸反应后,Fe2+有剩余;则加入稀硫酸时发生的反应3Fe2++NO3+4H+==3Fe3++NO↑+2H2O中NO3全部被还原为NO,根据元素守恒由n(NO)=0.02mol可得样品中m[Cu(NO3)2]=0.01 mol×188 g·mol1=1.88g,则 m(FeSO4)=17.08g1.88g=15.20g,其物质的量 n(FeSO4)=0.1 mol,原混合物中FeSO4的质量分数为 ![]() ×100%=89%,故 D 正确。反应 3Fe2++NO3+4H+==3Fe3++NO↑+2H2O中消耗的Fe2+为0.06mol,则溶液a中的 Fe2+为0.04mol,根据反应2Fe2++Cl2==2Fe3++2Cl可知,氧化 0.04 mol Fe2+需要 0.02molCl2 , 即n=0.02,故A正确。反应3Fe2++NO3+4H+==3Fe3++NO↑+2H2O 中消耗的H+为0.08mol,则溶液a中的H+为0.14mol×20.08 mol=0.2mol,根据铁元素守恒可知溶液a通入Cl2后含有0.1molFe3+ , 溶液 a 中还 0.01molCu2+;反应 2Fe3++Fe==3Fe2+消耗0.05molFe,反应Cu2++Fe==Cu+Fe2+消耗0.01 molFe,同时生成0.01molCu,反应Fe+2H+==Fe2++H2↑消耗 0.1 molFe,生成0.1molH2 , 标准状况下H2体积为2240mL,故B正确。通过以上分析可知,生成的Cu的质量为0.64 g,剩余Fe的质量为9 g(0.05+0.01+0.1) mol×56g·mol1=0.04g,则最后过滤所得固体质量 m=(0.64+0.04) g=0.68g,故C不正确。
×100%=89%,故 D 正确。反应 3Fe2++NO3+4H+==3Fe3++NO↑+2H2O中消耗的Fe2+为0.06mol,则溶液a中的 Fe2+为0.04mol,根据反应2Fe2++Cl2==2Fe3++2Cl可知,氧化 0.04 mol Fe2+需要 0.02molCl2 , 即n=0.02,故A正确。反应3Fe2++NO3+4H+==3Fe3++NO↑+2H2O 中消耗的H+为0.08mol,则溶液a中的H+为0.14mol×20.08 mol=0.2mol,根据铁元素守恒可知溶液a通入Cl2后含有0.1molFe3+ , 溶液 a 中还 0.01molCu2+;反应 2Fe3++Fe==3Fe2+消耗0.05molFe,反应Cu2++Fe==Cu+Fe2+消耗0.01 molFe,同时生成0.01molCu,反应Fe+2H+==Fe2++H2↑消耗 0.1 molFe,生成0.1molH2 , 标准状况下H2体积为2240mL,故B正确。通过以上分析可知,生成的Cu的质量为0.64 g,剩余Fe的质量为9 g(0.05+0.01+0.1) mol×56g·mol1=0.04g,则最后过滤所得固体质量 m=(0.64+0.04) g=0.68g,故C不正确。
