题目内容
已知下列热化学方程式
(l) C(s)+1/2O2(g)=CO(g) △H1=-110.5kJ/mol
(2)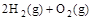 =2H2O(g) △H2=-483.6 kJ·
=2H2O(g) △H2=-483.6 kJ·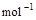
由此可知 C(s)+ H2O(g) == CO(g) + H2(g) ΔH3。则 ΔH3等于
(l) C(s)+1/2O2(g)=CO(g) △H1=-110.5kJ/mol
(2)
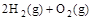 =2H2O(g) △H2=-483.6 kJ·
=2H2O(g) △H2=-483.6 kJ·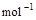
由此可知 C(s)+ H2O(g) == CO(g) + H2(g) ΔH3。则 ΔH3等于
| A.+131.3kJ·mol—1 | B.-131.3kJ·mol—1 |
| C.+373.1kJ·mol—1 | D.-373.1kJ·mol—1 |
A
考查盖斯定律的应用。由(1)-(2)÷2即得到C(s)+ H2O(g) == CO(g) + H2(g),所以该反应的反应速率是-110.5kJ/mol+483.6kJ/mol÷2=+131.3kJ·mol—1,答案选A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 O2 (g)
O2 (g)  O2(g) ="=" H2O(l);△H= —142.9kJ/mol
O2(g) ="=" H2O(l);△H= —142.9kJ/mol 2SO3,当生成2 mol SO3时放出热量为Q,现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则( )
2SO3,当生成2 mol SO3时放出热量为Q,现将1 mol SO2和0.5 mol O2在相同条件下反应生成SO3放出的热量为Q1,则( )