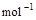题目内容
下列推论正确的是( )
| A.S(g)+O2(g)===SO2(g) ΔH=a;S(s)+O2(g)===SO2(g) ΔH=b;则a>b |
| B.C(石墨,s)===C(金刚石,s) ΔH=+1.9 kJ/mol,则可判定石墨比金刚石稳定 |
| C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.4 kJ/mol,则含20 g NaOH的溶液与稀盐酸完全反应,放出的热量为28.7 kJ |
| D.CaCO3(s)===CaO(s)+CO2(g) ΔH>0,则该反应任何温度下都能自发进行 |
B
由于气态硫的能量大于固态硫的能量,所以气态硫燃烧放出的热量多,但放热越多,△H越小,A不正确。B中反应是吸热反应,说明石墨的能量低于金刚石的,能量越低越稳定,B正确。C不正确,因为无法确定盐酸的物质的量。选项D中根据△G=△H-T·△S可知,该反应应该在高温下自发,不正确,所以答案选B。

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
 2NH3(g) +
2NH3(g) + 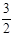 O2(g) ;△H =" a" kJ·mol—1
O2(g) ;△H =" a" kJ·mol—1 2H2O(l) ΔH = -571.6kJ·mol—1
2H2O(l) ΔH = -571.6kJ·mol—1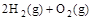 =2H2O(g) △H2=-483.6 kJ·
=2H2O(g) △H2=-483.6 kJ·