题目内容
航天飞船可用肼(N2H4)和过氧化氢(H2O2)为动力源。已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量。下列说法中错误的是( )
N2H4(l)+2H2O2(l)===N2(g)+4H2O(g) ΔH=-641.6 kJ·mol-1
| A.该反应中肼作还原剂 |
| B.液态肼的燃烧热为20.05 kJ·mol-1 |
| C.该动力源的突出优点之一是生成物对环境污染小 |
| D.肼和过氧化氢反应的热化学方程式为: |
B
1 g液态肼反应放热20.05 kJ,
则1 mol液态肼反应放热为:20.05 kJ/(1 g /32g·mol-1)=641.6 kJ·mol-1,故D正确;
分析元素化合价的变化:H2O2中-1价的氧反应后降低到H2O中的-2价,则肼(N2H4)中应存在元素化合价的升高,腈被氧化,做还原剂,故A正确;
燃烧热的定义:在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,故B错误;
则1 mol液态肼反应放热为:20.05 kJ/(1 g /32g·mol-1)=641.6 kJ·mol-1,故D正确;
分析元素化合价的变化:H2O2中-1价的氧反应后降低到H2O中的-2价,则肼(N2H4)中应存在元素化合价的升高,腈被氧化,做还原剂,故A正确;
燃烧热的定义:在25℃,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,故B错误;

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
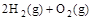 =2H2O(g) △H2=-483.6 kJ·
=2H2O(g) △H2=-483.6 kJ·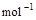


 2SO3(g);ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法中正确的是( )
2SO3(g);ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法中正确的是( )