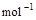题目内容
1840年,瑞士化学家盖斯(G.H.Hess)从大量的实验事实中总结出了一条规律:化学反应不管是一步完成还是分几步完成,其反应焓变是相同的,即盖斯定律.盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应焓变虽然无法直接测得,但可以利用盖斯定律间接计算求得.已知3.6 g碳在6.4 g氧气中燃烧,至反应物耗尽.共放出x kJ热量.已知单质碳的燃烧热为了y kJ·mol-1,则1 mol C与O2反应生成CO的反应焓变△H为 ( )
| A.-y kJ·mol-1 |
| B.-(10x-y)kJ·mol-1 |
| C.-(5x-0.5y)kJ·mol-1 |
| D.(10x-y)kJ·mol-1 |
C
3.6 g碳在6.4 g氧气中燃烧,生成物是CO2和CO,其中CO2是0.1mol,CO是0.2mol。所以根据反应c(s)+O2(g)=CO2(g) △H=-y kJ·mol-1可知,生成0.1molCO2放出的热量是0.1ykJ,所以生成0.2molCO放出的热量是xkJ-0.1ykJ,因此1 mol C与O2反应生成CO的反应焓变△H为-(5x-0.5y)kJ·mol-1,答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
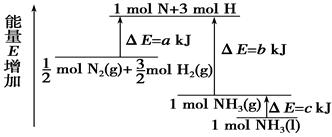
 2NH3(g) +
2NH3(g) + 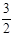 O2(g) ;△H =" a" kJ·mol—1
O2(g) ;△H =" a" kJ·mol—1 2H2O(l) ΔH = -571.6kJ·mol—1
2H2O(l) ΔH = -571.6kJ·mol—1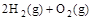 =2H2O(g) △H2=-483.6 kJ·
=2H2O(g) △H2=-483.6 kJ·