题目内容
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
① 0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3-)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
③已知25℃时,CH3COOH(aq)+OH-( aq)=CH3COO-(aq) +H2O △H=-akJ/mol,H+(aq) +OH-(aq) =H2O △H=-b kJ/mol,醋酸电离的热化学方程式为________________。
④将少量CO2通入NaCN溶液,反应的离子方程式是____________________________。
⑤室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是______________,溶液中c(CH3COO-)/c(CH3COOH) =___________。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。
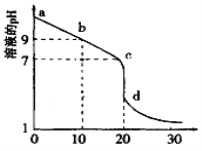
① d点所示的溶液中离子浓度由大到小的顺序依次为____________。
② b点所示的溶液中c(NH3·H2O)-c(NH4+)=_________(用溶液中的其它离子浓度表示)。
【答案】< ABC CH3COOH(aq)![]() CH3COO-(aq)+H+(aq) △H=(-a+b)kJ/mol CN-+CO2+H2O=HCN+HCO3- CH3COO-+H2O
CH3COO-(aq)+H+(aq) △H=(-a+b)kJ/mol CN-+CO2+H2O=HCN+HCO3- CH3COO-+H2O![]() CH3COOH+OH- l.8×104 c(C1-)>c(NH4+)>c(H+)>c(OH-) 2 c(H+)-2c(OH-)
CH3COOH+OH- l.8×104 c(C1-)>c(NH4+)>c(H+)>c(OH-) 2 c(H+)-2c(OH-)
【解析】
(1)①依据Ka(HCN)、Ka(H2CO3)的大小比较,即可知道c(CN-)、c(HCO3-)的关系;
②依据表中数据Ka(CH3COOH)、Ka(HCN)、Ka2(H2CO3)根据越弱越水解的规律,分析pH相同的三种溶液的浓度大小;
③根据盖斯定律可得醋酸电离的热化学方程式;
④根据表中数据可知,Ka1(H2CO3)![]() Ka(HCN)
Ka(HCN)![]() Ka2(H2CO3),依据强酸制弱酸得的反应规律,分析可得将少量CO2通入NaCN溶液,反应的离子方程式;
Ka2(H2CO3),依据强酸制弱酸得的反应规律,分析可得将少量CO2通入NaCN溶液,反应的离子方程式;
⑤CH3COONa溶液显碱性的原因是CH3COO-反生水解反应,依据Ka(CH3COOH)及溶液中的c(H+),可求算c(CH3COO-)/c(CH3COOH);
(2)①d点时加入盐酸20ml,恰好生成氯化铵,分析NH4Cl溶液中的离子浓度顺序即可;
②b点时,加入的盐酸体积为氨水的一半,所以溶液的成分可以看成,氯化铵和氨水的混合物,依据氨水的电离和氯化铵的水解程度大小可知c(NH3·H2O)-c(NH4+);
(1)①由于Ka(HCN)![]() Ka(H2CO3),可知HCN的酸性比H2CO3酸性弱,依据越弱越水解规律,0.1 moI/L NaCN溶液中,CN-的水解能力大于0.1mol/L NaHCO3溶液中HCO3-的水解能力,则c(CN-)
Ka(H2CO3),可知HCN的酸性比H2CO3酸性弱,依据越弱越水解规律,0.1 moI/L NaCN溶液中,CN-的水解能力大于0.1mol/L NaHCO3溶液中HCO3-的水解能力,则c(CN-)![]() c(HCO3-);
c(HCO3-);
本题答案为:<。
②由于Ka(CH3COOH)![]() Ka(HCN)
Ka(HCN)![]() Ka2(H2CO3),依据越弱越水解规律可知,等物质的量浓度的CH3COONa 、NaCN、Na2CO3,溶液的水解能力CO32-
Ka2(H2CO3),依据越弱越水解规律可知,等物质的量浓度的CH3COONa 、NaCN、Na2CO3,溶液的水解能力CO32-![]() CN-
CN-![]() CH3COO-,此时溶液pH由大到小的顺序为:Na2CO3
CH3COO-,此时溶液pH由大到小的顺序为:Na2CO3![]() CH3COONa;则pH相同时,浓度顺序为:CH3COONa
CH3COONa;则pH相同时,浓度顺序为:CH3COONa![]() NaCN
NaCN![]() Na2CO3,即ABC;
Na2CO3,即ABC;
本题答案为: ABC。
③因为CH3COOH(aq)+OH-( aq)=CH3COO-(aq) +H2O △H=-akJ/mol;H+(aq) +OH-(aq) =H2O △H=-b kJ/mol,依据盖斯定律,两式相减得到醋酸电离的热化学方程式为:CH3COOH(aq)![]() CH3COO-(aq)+H+(aq) △H=(-a+b)kJ/mol;
CH3COO-(aq)+H+(aq) △H=(-a+b)kJ/mol;
本题答案为:CH3COOH(aq)![]() CH3COO-(aq)+H+(aq) △H=(-a+b)kJ/mol。
CH3COO-(aq)+H+(aq) △H=(-a+b)kJ/mol。
④根据表中数据可知,Ka1(H2CO3)![]() Ka(HCN)
Ka(HCN)![]() Ka2(H2CO3),依据强酸制弱酸得的反应规律,将少量CO2通入NaCN溶液,反应的离子方程式为:CN-+CO2+H2O=HCN+HCO3-;
Ka2(H2CO3),依据强酸制弱酸得的反应规律,将少量CO2通入NaCN溶液,反应的离子方程式为:CN-+CO2+H2O=HCN+HCO3-;
本题答案为:CN-+CO2+H2O=HCN+HCO3-。
⑤CH3COONa溶液显碱性的原因是,CH3COO-反生水解反应,水解的离子方程式为:CH3COO-+H2O![]() CH3COOH+OH-;在溶液中CH3COOH的电离平衡常数Ka=c(CH3COO-)c(H+)/c(CH3COOH)=1.8
CH3COOH+OH-;在溶液中CH3COOH的电离平衡常数Ka=c(CH3COO-)c(H+)/c(CH3COOH)=1.8![]() ,pH=9,c(H+)=
,pH=9,c(H+)=![]() mol/L,所以c(CH3COO-)/c(CH3COOH) =1.8
mol/L,所以c(CH3COO-)/c(CH3COOH) =1.8![]() ;
;
本题答案为:CH3COO-+H2O![]() CH3COOH+OH-,1.8
CH3COOH+OH-,1.8![]() 。
。
(2)①d点时加入盐酸20ml,两溶液恰好生成氯化铵,由于铵离子水解显酸性,即c(H+)![]() c(OH-),又由电荷守恒可知c(Cl-)
c(OH-),又由电荷守恒可知c(Cl-)![]() NH4+),所以溶液中离子浓度由大到小的顺序依次为:c(C1-)>c(NH4+)>c(H+)>c(OH-);
NH4+),所以溶液中离子浓度由大到小的顺序依次为:c(C1-)>c(NH4+)>c(H+)>c(OH-);
本题答案为:c(C1-)>c(NH4+)>c(H+)>c(OH-)。
②b点时,所加盐酸体积为10ml,此时溶液为等浓度的氯化铵和氨水的混合物,由于一水合氨的电离程度大于氯化铵的水解程度,溶液显碱性,溶液中的电荷守恒:c(NH4+)![]() c(H+)=c(Cl-)
c(H+)=c(Cl-)![]() c(OH-)、物料守恒:2c(Cl-)=c(NH4+)
c(OH-)、物料守恒:2c(Cl-)=c(NH4+)![]() c(NH3·H2O),可以推知c(NH3·H2O)-c(NH4+)=2 c(H+)-2c(OH-) ;
c(NH3·H2O),可以推知c(NH3·H2O)-c(NH4+)=2 c(H+)-2c(OH-) ;
本题答案为:2 c(H+)-2c(OH-) 。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案