题目内容
8.W粒子的结构如图所示,下列关于它的说法不正确的是( )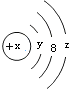
| A. | Y=2 | B. | 若X=14,它的氢化物的化学式为H2X | ||
| C. | 若X=18,则Z=8 | D. | 若X=17,它的氧化物化学式为W2O7 |
分析 A.第一电子层容纳2个电子,故Y=2;
B.若X=14,则W为Si元素,最低负价为-4;
C.若X=18,则为Ar元素;
D.若X=17,则为Cl元素,最高正化合价为+7,据此书写化学式.
解答 解:A.微粒有3个电子层,第一电子层填充满电子,第一电子层容纳2个电子,故Y=2,故A正确;
B.若X=14,则W为Si元素,其氢化物的化学式为SiH4,故B错误;
C.若X=18,则为Ar元素,则Z=8,故C正确;
D.若X=14,则为Cl元素,最高正化合价为+7,最高价氧化物的化学式为Cl2O7,故D正确;
故选B.
点评 本题考查核外电子排布规律、微粒中质子数与电子数关系、结构位置性质关系等,题目难度不大,注意W粒子可能是阴离子、阳离子或中性原子.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.用铂电极电解下列溶液时,阴极和阳极上均产生气体,且体积比为1:1的是( )
| A. | 稀NaOH | B. | HCl | C. | 酸性MgSO4 | D. | 酸性AgNO3 |
20.下列试剂中可用于除去CO2中少量SO2杂质的有( )
①饱和NaHCO3溶液 ②酸性KMnO4溶液 ③溴水 ④饱和Na2CO3溶液.
①饱和NaHCO3溶液 ②酸性KMnO4溶液 ③溴水 ④饱和Na2CO3溶液.
| A. | ②③④ | B. | ①③④ | C. | ①②③ | D. | ①②④ |
17.下列变化一定会引起平衡移动的是( )
①反应速率的变化 ②浓度的变化 ③各组分百分含量的变化 ④平均相对分子质量的变化
⑤颜色的变化 ⑥混合气体密度的变化 ⑦转化率的变化 ⑧温度的变化.
①反应速率的变化 ②浓度的变化 ③各组分百分含量的变化 ④平均相对分子质量的变化
⑤颜色的变化 ⑥混合气体密度的变化 ⑦转化率的变化 ⑧温度的变化.
| A. | ①②⑥⑦⑧ | B. | ②④⑤⑥⑧ | C. | ②④⑤⑥⑦ | D. | ③④⑦⑧ |
3.下列说法中,正确的是( )
| A. | 两种物质的组成元素相同,各元素的质量分数也相同,则两者一定互为同分异构体 | |
| B. | 分子式为CnH2n的化合物,可能使酸性KMnO4溶液褪色,也可能不使其褪色 | |
| C. | 通式相同,分子组成上相差一个或若干个CH2原子团的化合物,一定互为同系物 | |
| D. | 凡含有苯环的物质都是芳香烃 |
20.下列说法正确的是( )
| A. | 石油经过分馏及裂化等方法得到的物质均为纯净物 | |
| B. | 乙酸乙酯、油脂、葡萄糖、蛋白质均可以发生水解反应 | |
| C. | 化合物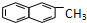 是苯的同系物 是苯的同系物 | |
| D. | 地沟油和矿物油可通过加足量的氢氧化钠溶液加热后的不同现象加以区别 |
17.下列说法正确的是( )
| A. | 共价化合物中不含离子键 | |
| B. | 凡是金属元素跟非金属元素化合形成离子化合物 | |
| C. | 离子化合物中的阳离子都是金属离子 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |