题目内容
12.在标准状况下,由CO和CO2组成的混合气体13.44L,质量为21.6g,该混合气体的平均摩尔质量为36g/mol,该混合气体中,碳氧两种元素质量之比为1:2.分析 根据n=$\frac{V}{{V}_{m}}$计算混合气体总物质的量,再根据M=$\frac{m}{n}$计算混合气体平均摩尔质量,结合总质量列方程计算CO、CO2的物质的量,再根据m=nM计算碳、氧元素质量之比.
解答 解:CO和CO2组成的混合气体总物质的量为$\frac{13.44L}{22.4L/mol}$=0.6mol,二者总质量为21.6g,则平均摩尔质量为$\frac{21.6g}{0.6mol}$=36g/mol,
设CO和CO2的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.6}\\{28x+44y=21.6}\end{array}\right.$
解得x=y=0.3mol,
故混合物中碳、氧元素质量之比为(0.3+0.3)mol×12g/mol:(0.3+0.2×2)mol×16g/mol=1:2,
故答案为:36g/mol;1:2.
点评 本题考查混合物计算,侧重物质的量有关计算考查,比较基础,可以利用十字交叉法计算CO、CO2的物质的量之比.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.判断一个化学反应是否属于氧化还原反应的方法是( )
| A. | 观察是否发生了化合反应 | |
| B. | 观察是否有氧气参加反应 | |
| C. | 观察是否有单质参加反应 | |
| D. | 观察反应前后是否有元素的化合价发生变化 |
4.下列物质间的反应属于消去反应的是( )
| A. | 乙烯气体通入溴的四氯化碳溶液 | |
| B. | 加热浓硝酸和苯(浓硫酸作催化剂)制取硝基苯 | |
| C. | 加热溴乙烷和氢氧化钾的水溶液 | |
| D. | 加热溴乙烷和氢氧化钾的醇溶液 |
13.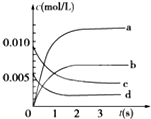 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)800℃,反应达到平衡时,NO的物质的量浓度是0.0035mol/L;升高温度,NO的浓度增大,则该反应是放热(填“放热”或“吸热”)反应.
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=0.0015mol/(L•s).
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=0.0015mol/(L•s).
(3)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
 H++HS-HS-
H++HS-HS-