题目内容
【题目】下列描述中正确的是( )
A. CS2分子构型为V形 B. ClO3—的空间构型为平面三角形
C. SF6中有4对完全相同的成键电子对 D. SiF4和SO32-的中心原子均为sp3杂化
【答案】D
【解析】
A、CS2分子中中心原子碳原子含有的孤对电子对数=![]() =0,所以该分子是直线型结构,属于含有极性键的非极性分子,选项A不正确;B、ClO3-中中心原子氯原子含有的孤对电子对数=
=0,所以该分子是直线型结构,属于含有极性键的非极性分子,选项A不正确;B、ClO3-中中心原子氯原子含有的孤对电子对数=![]() =1,所以该微粒是三角锥形结构,选项B不正确;C、在SF6分子中,S和F形成的是极性键,6个共价键完全是相同,即有6对完全相同的成键电子对,选项C不正确;D、SiF4和的空间构型分别为正四面体和三角锥形,但中心原子均采用的是sp3杂化,选项D正确。答案选D。
=1,所以该微粒是三角锥形结构,选项B不正确;C、在SF6分子中,S和F形成的是极性键,6个共价键完全是相同,即有6对完全相同的成键电子对,选项C不正确;D、SiF4和的空间构型分别为正四面体和三角锥形,但中心原子均采用的是sp3杂化,选项D正确。答案选D。

 阶梯计算系列答案
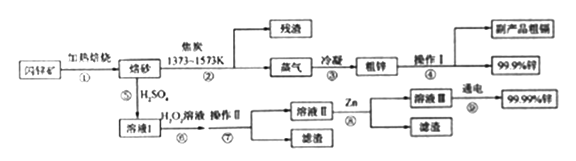
阶梯计算系列答案【题目】闪锌矿(主要成分ZnS,含Cd、Fe、Cu等元素杂质)是冶炼锌单质的原料,有两种常见的冶炼方式:火法炼锌和湿法炼锌。两种方法均先将闪锌矿加热焙烧,得到以ZnO为主要成分的焙砂,再分别经过两条路线得到单质锌,同时得到副产品。
已知:
(I)相关金属单质的熔沸点
金属单质 | Zn | Fe | Cu | Cd |
熔点(K) | 693 | 1812 | 1356 | 594 |
沸点(K) | 1180 | 3023 | 2840 | 1040 |
(II)几种离子生成氢氧化物沉淀的pH
开始沉淀pH | 完全沉淀 pH | |
Fe3+ | l.l | 3.2 |
Zn2+ | 5.9 | 8.9 |
Cu2+ | 4.7 | 6.7 |
Cd2+ | 6.9 | 9.6 |
请回答下列问题:
(1)写出步骤①发生的主要反应的化学方程式___________________。
(2)步骤②若焦炭与ZnO(s)反应生成1mol CO时吸收akJ的热量,请写出该反应的热化学方程示________________。
(3)步骤④中操作I的分离方法为_______,得到副产品粗 镉需控制温度为_____左右。
(4)步骤⑦需调节溶液pH为_______,目的是__________。
(5)步骤⑨以Pt为阳极、Al为阴极进行电解的化学方程式为__________。
(6)分别取闪锌矿200kg,通过火法炼锌得到Zn的质量为65kg,通过湿法炼锌得到Zn的质量为78kg,闪锌矿中ZnS的质量分数约为________。